题目内容
11.在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用7.3%的稀盐酸来测定其溶质的质量分数.以下是几组同学的设想及做法:(1)甲组同学的实验如图1所示:在烧杯中加入16g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入7.3%的稀盐酸,并不断搅拌,当观察到现象时,说明它们之间发生了中和反应,且恰好完全反应.当溶液颜色恰好变为无色时,共用去了稀盐酸20g.
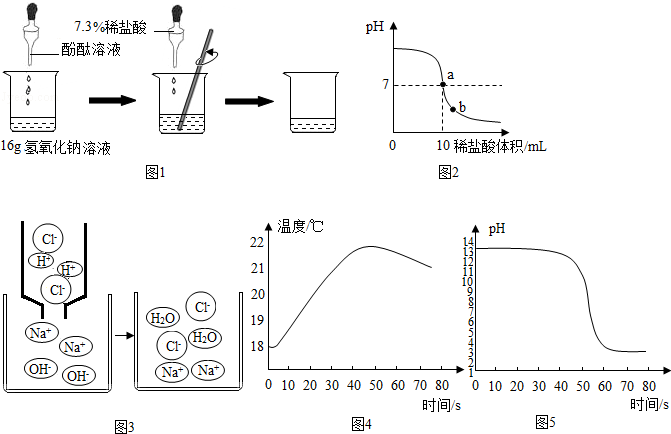
试计算:
①则甲组这瓶氢氧化钠溶液中溶质的质量分数为10%?(以下两小题必须写出完整的计算过程).
②试列式计算说明将该反应后的溶液转化为20℃时饱和溶液的一种简单方法(计算结果精确到0.1g).已知:20℃时氯化钠的溶解度为36.0g.
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入7.3%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的.
①下列使用pH试纸的方法正确的是AC(填字母).
A.将pH试纸剪成几段节约使用B.将pH试纸直接插入待测液中
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确.在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图象(简单表示为图2).
请回答:图2中a点表示的含义是氢氧化钠与盐酸恰好完全反应;b点溶液中含有的阳离子有Na+、H+(填离子符号).
(3)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生.这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质.
请用化学方程式表示其变质的原因CO2+2NaOH=Na2CO3+H2O;若要除去溶液中变质生成的杂质,请简要写出你的实验方案:加适量的氢氧化钙溶液(或氢氧化钡溶液),过滤.
(4)①图3是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,
根据如图回答下列问题:该中和反应的实质可以表示为氢离子+氢氧根离子→水.
②将稀盐酸逐滴匀速加入一定量的稀氢氧化钠溶液中,用数字化仪器对反应过程中溶液的温度、pH进行实时测定,得到的曲线如图4、图5所示.
由图4、图5可知,稀盐酸与稀氢氧化钠溶液恰好反应依据是溶液温度升高、溶液pH由大于7降至小于7.
(5)中和反应不一定有有明显实验现象产生.对于某些有明显实验现象产生的中和反应,如稀硫酸与氢氧化钡溶液的反应,只要将稀硫酸滴加到氢氧化钡溶液中,观察到产生白色沉淀现象,就可说明反应已经发生.该反应的化学方程式是Ba(OH)2+H2SO4═BaSO4↓+2H2O.
分析 (1)①根据氢氧化钠与盐酸的反应,由盐酸溶质的质量求出氢氧化钠的质量,再求出氢氧化钠溶液中溶质的质量分数;②根据20℃是氯化钠的溶解度,结合溶液中含有的氯化钠质量分析使其转化为20℃时的饱和溶液的方法.
(2)①根据pH试纸使用方法分析判断;
②根据溶液pH的变化图象的意义,分析a的含义、b点溶液中的溶质;由盐酸的体积和密度可求出盐酸的质量.
(3)根据氢氧化钠与二氧化碳的反应写出氢氧化钠变质的方程式,根据碳酸钠的性质分析设计除去碳酸钠的实验方案.
(4)显酸性的溶液不能使酚酞试液变色,显碱性的溶液能使酚酞试液变红色;
稀盐酸和氢氧化钠反应时放出热量;
氢氧化钠溶液显碱性,pH大于7,当不断加入稀盐酸时,由于发生中和反应,溶液的碱性减弱,pH减小,当恰好完全反应时,pH等于7,继续加入稀盐酸时,溶液显酸性,pH小于7;
(5)氢氧化钡和稀硫酸反应生成白色沉淀硫酸钡和水.
解答 解:(1)①酚酞遇碱性溶液变红,酚酞溶液的作用是:判断反应是否恰好完成;
②在中和反应过程中,边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是:使反应物充分接触,完全反应;
③盐酸中溶质的质量为:20g×7.3%=1.46g
设氢氧化钠的质量为x,生成氯化钠的质量为y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
x 1.46g y
$\frac{40}{x}=\frac{36.5}{1.46g}$=$\frac{58.5}{y}$
解得:x=1.6g
y≈2.3g
甲组这瓶氢氧化钠溶液中溶质的质量分数为:$\frac{1.6g}{16}$×100%=10%
②由于该溶液在20℃时不饱和所以可采用加溶质的简便办法使其转化成饱和溶液,原溶液质量是20g+16g=36g;
设加入溶质的质量是z,则有
$\frac{36g}{100g+36g}=\frac{2.3g+z}{36g+z}$
z≈9.8g
(2)①A.将pH试纸剪成几段节约使用,方法正确;
B.将pH试纸直接插入待测液中,会污染试剂,方法错误;
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上,方法正确;
D.将pH试纸润湿后,测得碱液的pH偏小,方法错误;
②由溶液pH的变化图象可知,在a点时,溶液的pH等于7,说明了氢氧化钠和盐酸恰好中和;在b点时,溶液呈酸性,氢氧化钠全部与盐酸反应生成了氯化钠,溶液中还有剩余的盐酸.所以溶液中的阳离子是:Na+、H+;要求氢氧化钠溶液的质量质量分数,须知盐酸的质量,由题中的条件可知,还需要的数据是稀盐酸的密度.
(3)氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应,反应的方程式是:CO2+2NaOH=Na2CO3+H2O.由于碳酸钠能与氢氧化钙反应生成了氢氧化钠和碳酸钙,既除去了杂质碳酸钠,又没有引入新的杂质.所以,要除去溶液中变质生成的杂质,实验方案是:加适量的氢氧化钙溶液(或氢氧化钡溶液),过滤;反应方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(4)①在盛有稀氢氧化钠溶液的烧杯中,滴加2~3滴酚酞试液,用胶头滴管吸取稀盐酸逐滴加入到上述烧杯中,边滴边用玻璃棒搅拌,当观察到溶液由红色变成无色时,说明它们之间发生了中和反应,且恰好完全反应;中和反应的实质是:氢离子+氢氧根离子→水;
②由图1、图2可知,稀盐酸与稀氢氧化钠已发生中和反应的判断依据是溶液温度升高;溶液pH由大于7降至小于7.
(5)将稀硫酸滴加到氢氧化钡溶液中时,能够观察到产生白色沉淀,就可说明反应已经发生,该反应的化学方程式为:Ba(OH)2+H2SO4═BaSO4↓+2H2O.
故填:产生白色沉淀;Ba(OH)2+H2SO4═BaSO4↓+2H2O.
答案:
(1)①10%;②9.8g;
(2)①AC;②氢氧化钠与盐酸恰好完全反应;Na+、H+;
(3)CO2+2NaOH=Na2CO3+H2O;加适量的氢氧化钙溶液(或氢氧化钡溶液),过滤;
(4)①氢离子+氢氧根离子→水;②溶液温度升高;溶液pH由大于7降至小于7.
(5)产生白色沉淀;Ba(OH)2+H2SO4═BaSO4↓+2H2O.
点评 本题是考查中和反应过程中溶液pH的变化情况的,我们要知道向酸中加碱和向碱中加酸时,溶液pH的变化趋向.明确不同指示剂的变色范围.

| A. | 浓盐酸 | B. | 浓硫酸 | C. | 生石灰 | D. | 氢氧化钠 |
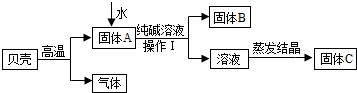
(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
(2)操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使溶液体受热均匀,防止液滴外溅
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH
乙:NaOH和Na2CO3的混合物
丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量稀盐酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和溶液碳酸钠溶液 | 生成白色沉淀 | 猜想成立 |

已知相关物质的溶解度(20℃)如下表:
| 物质 | K2CO3 | K2SO4 | KMnO4 |
| 溶解度/g | 111 | 11.1 | 6.34 |
(2)操作I的名称是过滤.“干燥”过程中温度不宜过高的原因是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑(用化学方程式表示).
(3)“通CO2酸化”,反应的化学方程式为:3K2 MNO4+2CO2═2KmnO4+MnO2↓+2K2 CO3
著用稀H2SO4酸化,反应的化学方程式为:3K2 MNO4+2H2 SO4═2KMnO4+MnO2↓+2K2SO4+2H2O
工业上不采用稀H2SO4酸化的原因是相同条件下,硫酸钾和高锰酸钾的溶解度都比较小,无法采用浓缩结晶的方法加以分离.
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:3K2 MNO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是生成的氢氧化钾可以循环使用.
| 序号 | (1) | (2) | (3) | (4) | (5) |
| 名称 | 亚硫酸 | 氖气 | 碳酸氢铵 | 酒精 | |
| 化学式 | H2SO3 | Fe(OH)2 | NH4HCO3 | C2H5OH | |
| 类别 | |||||
| 化合价 | 0 | +2 | -2 |
 金属用途广泛,其结构、性质等是化学的重要研究内容.
金属用途广泛,其结构、性质等是化学的重要研究内容.(1)如图1是铝的原子结构.下列说法不正确的是C
A.铝原子的质子数为13
B.在化合物中铝通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
(2)某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图2实验,并对溶液A和固体B的成分进行了分析和研究.
【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
①只有Zn(NO3)2
②Zn(NO3)2、AgNO3
③Zn(NO3)2、Cu(NO3)2
④Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是② (填标号),其理由是猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,而铜能与硝酸银反应,所以不可能存在硝酸银.
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整.
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 取少量固体B,滴加稀盐酸 | 有气泡产生 | Zn+2HCl═ZnCl2+H2↑ |
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CuSO4粉末 | Fe粉 | 加水充分搅拌;过滤;将滤液蒸发结晶 |
| B | C粉 | CuO粉末 | 加入过量稀盐酸.充分反应后,过滤,凉干 |
| C | CO2气体 | CO | 通入氧气,点燃 |
| D | MnO2 | KClO3 | 充分加热后.冷却 |
| A. | A | B. | B | C. | C | D. | D |
| A. | (4m-5n)克 | B. | (5n-4m)克 | C. | (5m-5n) 克 | D. | (m-n)克 |
