题目内容
20.下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题.| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
| Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是有晶体析出,此时溶液的溶质质量分数为47.9%.(保留一位小数)
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:

(Ⅰ)步骤②中加入过量Ca(OH)2的目的是使Na2CO3充分反应;
涉及反应的化学方程式为_Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(Ⅱ)滤液B中的溶质是Ca(OH)2、NaOH(写化学式);
步骤③所包含的具体操作是加热浓缩、降温、过滤.
(Ⅲ)若实验前称得样品的质量为10g,实验后称得“滤渣A”和“NaOH固体”的质量分别是5g和8.7g,则此样品的纯度为47%.
分析 根据表格提供的数据结合物质的性质进行分析解答,部分变质的氢氧化钠中含有碳酸钠,要除去碳酸钠可以加入氢氧化钙溶液,据此解答.
解答 解;(1)根据表中的数据可以看出,氢氧化钠的溶解度随温度升高而增大,故填:氢氧化钠的溶解度随温度升高而增大;
(2)把80℃时NaOH的饱和溶液降温至20℃,氢氧化钠的溶解度随温度的降低而减小,可以看到有晶体析出,$\frac{91g}{100g+91g}×100%$≈47.9%,故填:有晶体析出,
47.9%;
(3)(Ⅰ)加入过量Ca(OH)2的目的是shi碳酸钠完全反应,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故填:使Na2CO3充分反应;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(Ⅱ)因为氢氧化钙过量,故B中含有氢氧化钙和氢氧化钠,步骤③得到了晶体,故还有降温的步骤,故填:Ca(OH)2、NaOH,降温;
(Ⅲ)设碳酸钠的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 5g
$\frac{106}{100}═\frac{x}{5g}$ x=5.3g
故氢氧化钠的质量为:10g-5.3g=4.7g
此样品的纯度为$\frac{4.7g}{10g}×100%=47%$.故填:47%.
点评 本题考查的是常见的碱的性质以及根据化学方程式的计算的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
10.在一次用餐中,同学们对燃料“固体酒精”产生了好奇,对其成分进行探究.
【查阅资料】
(1)该“固体酒精”是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成.
(2)氯化钙、氯化钡溶液均呈中性,Na2CO3溶液呈碱性.
【提出问题及猜想】
(1)酒精中是否含有碳元素?
(2)“固体酒精”中的氢氧化钠是否变质?通过分析,提出如下猜想:
①猜想Ⅰ:没有变质 猜想Ⅱ:已全部变质 猜想Ⅲ:部分变质
【实验探究】
(1)按如图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论,此结论合理(选填“合理”或“不合理”).
(2)对猜想Ⅲ进行分组探究.取少量“固体酒精”于烧杯中,加足量的水充分溶解后静置.
①甲组取烧杯上层清液于两支试管中,按如图探究.
②乙组认为甲组实验不能证明清液中一定有氢氧化钠,因碳酸钠溶液呈碱性也能使酚酞溶液变红.于是,他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后再滴加酚酞溶液,酚酞溶液变红.
【实验结论】经讨论一致认为猜想Ⅲ成立,此时上层清液中所含的溶质有酒精、氯化钠、碳酸钠和氢氧化钠.
【反思交流】乙组实验中加足量该溶液的目的是.除去碳酸钠.

【查阅资料】
(1)该“固体酒精”是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成.
(2)氯化钙、氯化钡溶液均呈中性,Na2CO3溶液呈碱性.
【提出问题及猜想】
(1)酒精中是否含有碳元素?
(2)“固体酒精”中的氢氧化钠是否变质?通过分析,提出如下猜想:
①猜想Ⅰ:没有变质 猜想Ⅱ:已全部变质 猜想Ⅲ:部分变质
【实验探究】
(1)按如图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论,此结论合理(选填“合理”或“不合理”).
(2)对猜想Ⅲ进行分组探究.取少量“固体酒精”于烧杯中,加足量的水充分溶解后静置.
①甲组取烧杯上层清液于两支试管中,按如图探究.
| 方案 | 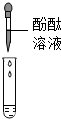 | 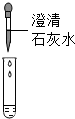 |
| 现象 | 溶液变红 | 产生白色沉淀 |
| 结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
【实验结论】经讨论一致认为猜想Ⅲ成立,此时上层清液中所含的溶质有酒精、氯化钠、碳酸钠和氢氧化钠.
【反思交流】乙组实验中加足量该溶液的目的是.除去碳酸钠.
11.诗词谚语是民族灿烂文化的瑰宝.下列名句中只含有物理变化的是( )
| A. | 野火烧不尽,春风吹又生 | B. | 粉身碎骨浑不怕,要留清白在人间 | ||
| C. | 宁为玉碎,不为瓦全 | D. | 同呼吸,共命运,共住一个地球村 |
8.下列有关碳及化合物的说法正确的是( )
| A. | 一氧化碳、二氧化碳都能使澄清石灰水变浑浊 | |
| B. | 大气中二氧化碳消耗的途径主要是绿色植物的光合作用 | |
| C. | 室内放一盆水能防止一氧化碳中毒 | |
| D. | 金刚石、石墨是碳的单质,而C60则是碳的化合物 |
15.下列实验设计能够达到实验目的是( )
| A. | 在空气中灼烧鉴别黄铜和黄金 | |
| B. | 用品尝的方法鉴别食用盐和工业用盐 | |
| C. | 用硫酸除去氯化钠溶液中的氢氧化钠 | |
| D. | 用酚酞试液检验氢氧化钠溶液是否变质 |
12. 如图是甲、乙两种物质的溶解度曲线,则下列叙述正确的是( )
如图是甲、乙两种物质的溶解度曲线,则下列叙述正确的是( )
 如图是甲、乙两种物质的溶解度曲线,则下列叙述正确的是( )
如图是甲、乙两种物质的溶解度曲线,则下列叙述正确的是( )| A. | 可用100g水配制60℃时溶液质量为180g的甲溶液 | |
| B. | 40℃时,甲、乙两物质溶液的溶质质量分数一定相等 | |
| C. | 升高温度可以将乙的饱和溶液转化为不饱和溶液 | |
| D. | 50℃时,甲物质的溶解度大于乙物质的溶解度 |
9.下列实验操作正确且通常可达到实验目的是( )
| A. | 用湿润的pH试纸测量某溶液的pH值 | |
| B. | 欲配制质量分数为10%的CuSO4溶液,将10gCuSO4•5H2O溶解在90g水中 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| D. | 实验室不能用排空气法收集CO,但可用排水法收集 |

 的垃圾箱中的是ABC(填字母序号).
的垃圾箱中的是ABC(填字母序号).