题目内容
10.在一次用餐中,同学们对燃料“固体酒精”产生了好奇,对其成分进行探究.
【查阅资料】
(1)该“固体酒精”是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成.
(2)氯化钙、氯化钡溶液均呈中性,Na2CO3溶液呈碱性.
【提出问题及猜想】
(1)酒精中是否含有碳元素?
(2)“固体酒精”中的氢氧化钠是否变质?通过分析,提出如下猜想:
①猜想Ⅰ:没有变质 猜想Ⅱ:已全部变质 猜想Ⅲ:部分变质
【实验探究】
(1)按如图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论,此结论合理(选填“合理”或“不合理”).
(2)对猜想Ⅲ进行分组探究.取少量“固体酒精”于烧杯中,加足量的水充分溶解后静置.
①甲组取烧杯上层清液于两支试管中,按如图探究.
| 方案 | 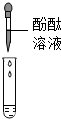 | 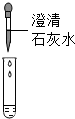 |
| 现象 | 溶液变红 | 产生白色沉淀 |
| 结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
【实验结论】经讨论一致认为猜想Ⅲ成立,此时上层清液中所含的溶质有酒精、氯化钠、碳酸钠和氢氧化钠.
【反思交流】乙组实验中加足量该溶液的目的是.除去碳酸钠.
分析 【提出问题及猜想】
氢氧化钠可能没有变质,也可能已全部变质,也可能部分变质;
【实验探究】
化学反应前后,元素的种类不变,原子的种类、总个数不变;
显碱性的溶液能使酚酞试液变红色;
碳酸钠能和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠;
碳酸钠能和氯化钡反应生成白色沉淀碳酸钡和氯化钠;
氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠.
解答 解:【提出问题及猜想】
①猜想Ⅰ:没有变质 猜想Ⅱ:已全部变质 猜想Ⅲ:部分变质.
故填:部分变质.
【实验探究】
(1)按如图实验,发现澄清石灰水变浑浊,说明固体酒精燃烧生成了二氧化碳,进一步说明固体酒精中含有碳元素,即酒精中含有碳元素,此结论合理.
故填:合理.
(2)向清液中加入澄清石灰水时,如果产生白色沉淀,说明清液中含有碳酸钠;
因碳酸钠溶液呈碱性也能使酚酞溶液变红,因此应该除去碳酸钠,方法是:另取烧杯中上层清液,加足量氯化钡溶液,充分反应后再滴加酚酞溶液,酚酞溶液变红,说明清液中含有氢氧化钠.
故填:白色沉淀;氯化钡.
【实验结论】
经讨论一致认为猜想Ⅲ成立,此时上层清液中所含的溶质有酒精、碳酸钠、氢氧化钠和氯化钙与碳酸钠反应生成的氯化钠.
故填:酒精、氯化钠、碳酸钠和氢氧化钠.
【反思交流】
乙组实验中加足量该溶液的目的是除去碳酸钠,以免对检验氢氧化钠产生影响.
故填:除去碳酸钠.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
20.维生素对调节人体新陈代谢、维持身体健康有重要作用,下列食物中富含维生素的是( )
| A. |  牛奶 | B. |  水果糖 | C. |  蔬菜 | D. |  花生油 |
1.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入稀硫酸中都没有现象发生;Y的硫酸盐溶液不能用Z的容器盛放.根据以上实验事实判断,X、Y、Z三种金属的活动性由强至弱的顺序正确的是( )
| A. | X Y Z | B. | Z Y X | C. | Y Z X | D. | X Z Y |
18.下列变化中属于化学变化的是( )
| A. | 酒精挥发 | B. | 铁生锈 | C. | 火柴折断 | D. | 固体粉碎 |
15.下列含硫元素的物质中,硫元素的化合价最高的是( )
| A. | H2SO4 | B. | H2SO3 | C. | Na2S | D. | Na2S2O3 |
2.如图所示的实验操作中,正确的是( )
| A. |  细铁丝燃烧 | B. |  稀释浓硫酸 | C. |  倾倒液体 倾倒液体 | D. |  点燃酒精灯 |
19.下列有关化学与生活的说法中,不正确的( )
| A. | 铅锑合金由于熔点低,用来做保险丝 | |
| B. | 用柠檬酸、果汁、白糖、水、小苏打等制汽水 | |
| C. | 用灼烧的方法鉴别棉布和丝绸 | |
| D. | 用活性炭可将硬水进行软化 |
20.下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题.
(1)从表中数据可以获得的信息是氢氧化钠的溶解度随温度升高而增大(写一条).
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是有晶体析出,此时溶液的溶质质量分数为47.9%.(保留一位小数)
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:

(Ⅰ)步骤②中加入过量Ca(OH)2的目的是使Na2CO3充分反应;
涉及反应的化学方程式为_Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(Ⅱ)滤液B中的溶质是Ca(OH)2、NaOH(写化学式);
步骤③所包含的具体操作是加热浓缩、降温、过滤.
(Ⅲ)若实验前称得样品的质量为10g,实验后称得“滤渣A”和“NaOH固体”的质量分别是5g和8.7g,则此样品的纯度为47%.
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
| Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是有晶体析出,此时溶液的溶质质量分数为47.9%.(保留一位小数)
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:

(Ⅰ)步骤②中加入过量Ca(OH)2的目的是使Na2CO3充分反应;
涉及反应的化学方程式为_Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(Ⅱ)滤液B中的溶质是Ca(OH)2、NaOH(写化学式);
步骤③所包含的具体操作是加热浓缩、降温、过滤.
(Ⅲ)若实验前称得样品的质量为10g,实验后称得“滤渣A”和“NaOH固体”的质量分别是5g和8.7g,则此样品的纯度为47%.