题目内容
10.下列图示中,A图是一种“化学氧自救器”,主要用于煤矿井下应急和机体缺氧病人的自救.它利用人呼出的二氧化碳与自救药罐中的生氧剂(超氧化钾KO2)接触产生氧气,该反应的化学方程式为:4KO2+2CO2=2X+3O2.
(1)上述化学方程式中,X的化学式为K2CO3.
(2)若要在实验室用高锰酸钾制取并收集一瓶氧气,你应选择图中的B(填字母序号)作为发生装置,其相应的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,收集装置应选G(填字母序号).
(3)如采用双氧水和二氧化锰在实验室制取氧气,在选择发生装置时,小桐认为应选C,小晨认为应选择D,你认为谁的选择更好?理由是小晨,控制反应速率(或节约药品,能够使反应随时发生,随时停止),该反应的化学方程式为2H202$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(4)实验室制备并收集二氧化碳气体应选用的装置有CE(填字母序号).
(5)实验室常用加热NH4Cl和Ca(OH)2固体混合物的方法制取氨气(NH3),则制取氨气的发生装置应选用B.收集氨的装置只能用F,而不能用E或G,由此可知氨气应具有的性质是密度比空气小,溶于水.
分析 (1)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,即可推断X的化学式;
(2)根据实验室用高锰酸钾制取氧气用的是固体加热型的发生装置,收集纯净的氧气用排水法,并据反应原理书写化学方程式即可;
(3)根据双氧水和二氧化锰在实验室制取氧气的发生装置为固液常温型,依据分液漏斗可 利用活塞控制滴液的快慢,从而控制反应速率,节约药品,能够使反应随时发生,随时停止.进行分析解答;根据书写化学方程式的步骤:写配注等,正确书写化学方程式即可;
(4)根据实验室制取二氧化碳用石灰石和稀盐酸常温反应,属于固液常温型,故选发生装置C,二氧化碳的密度比空气大且能溶于水,所以用向上排空气法收集,据反应原理书写化学方程式;
(5)根据实验室制取氨气的反应物是固体,反应条件是加热,收集氨气的装置只能用向下排空气法收集进行分析.
解答 解:(1)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,反应的化学方程式:4KO2+2CO2=2X+3O2,反应前4个K,12个O,2个C,反应后6个O,可推断X的化学式为:K2CO3;
(2)根据实验室用高锰酸钾制取氧气用的是固体加热型的发生装置,因此发生装置选B;依据氧气不易溶于水,收集纯净的氧气用排水法,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,收集装置应选G;
(3)双氧水和二氧化锰在实验室制取氧气的发生装置为固液常温型,分液漏斗可 利用活塞控制滴液的快慢,控制反应速率,节约药品,能够使反应随时发生,随时停止.因此小晨的选择更好;
根据书写化学方程式的步骤:写配注等,双氧水和二氧化锰在实验室制取氧气的反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)实验室制取二氧化碳用石灰石和稀盐酸常温反应,属于固液常温型,故选发生装置C,二氧化碳的密度比空气大且能溶于水,所以用向上排空气法收集,故选E;
(5)实验室制取氨气的反应物是固体,反应条件是加热,收集氨气的装置只能用向下排空气法收集,所以制取氨气的发生装置应选用B.收集氨的装置只能用F,而不能用E或G,可知氨气应具有的性质是密度比空气小,溶于水.
故答案为:(1)①K2CO3 ;
(2)B,2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,G;
(3)小晨,控制反应速率(或节约药品,能够使反应随时发生,随时停止),2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)CE;
(5)B,密度比空气小,溶于水.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

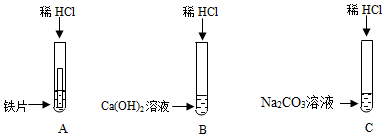
(1)写出A试管中的反应现象铁片表面有气泡产生,溶液由无色逐渐变为浅绿色
(2)写出B试管中反应的化学方程式Ca(OH)2+2HCl═CaCl2+2H2O
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成.同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究.
【提出猜想】
甲同学猜想:NaCl; 乙同学猜想:NaCl、CaCl2;丙同学猜想:NaCl、CaCl2、HCl;
你的猜想:NaCl、Na2CO3.
【交流讨论】你认为丙同学的猜想一定不正确,理由是白色沉淀是CaCO3,能与盐酸反应,二者不能共存.
【设计实验】请设计实验证明你的猜想正确.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,向其中滴加无色酚酞试液 | 无色酚酞试液变红 | 猜想成立 |
资料摘要:
Ⅰ.碳酸钠和氯化钙能发生复分解反应.
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为不洗涤碳酸钙,表面可能会附着一层可溶性物质使沉淀物质量增加,所以使得计算出的碳酸钠的质量增大.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).

(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒 定律,装置质量守恒(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
 酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.
酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成.
【猜想与假设】
I.红色褪去,与NaOH溶液和空气中的CO2反应有关.
II.红色褪去,与NaOH溶液的浓度有关.
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关.
【进行实验】
| 实验 | 实验操作 | 实验现象 | |
| 1 | 向盛有2mLNa2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 | |
| 2 |  | 1号试管0.1min红色褪去 2号试管5min红色褪去 3号试管30min红色明显变浅 4号试管120min红色无明显变化 | |
| 3 | 取3支试管,分别加入2mL水,分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液. | 酚酞溶液浓度% | 浑浊程度 |
| 5 | 大量混浊物 | ||
| 2 | 少量浑浊物 | ||
| 0.5 | 无浑浊物 | ||
(1)实验l的现象表明,猜想与假设l不成立(填“成立”或“不成立”).
(2)由实验2可得出结论:与NaOH浓度有关,浓度过高会使酚酞褪色.
(3)请将实验3的操作步骤补充完整.取3支试管,分别加入2mL水,分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液.
【反思与评价】
(4)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%.建议选用NaOH溶液的浓度为0.5%.
| A. | 尽量乘坐公交车或骑自行车出行 | B. | 露天焚烧废旧塑料解决“白色污染” | ||
| C. | 用清洁能源代替化石燃料 | D. | 植树造林增加绿化面积 |
 水是重要资源.
水是重要资源. 如图是A、B、C、三种物质的溶解度曲线.
如图是A、B、C、三种物质的溶解度曲线.