题目内容
现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液,为了测定碱性调味液中碳酸钠和氯化钠的质量分数,设计了如下实验方案
【实验一】
取三份碱性调味液各100g,分别缓慢加入到20g、40g和60g某盐酸中,测得三组实验数据见下表(气体的溶解忽略不计):
根据实验及有关数据进行分析与计算:
(1)100g碱性调味液与盐酸完全反应生成气体的质量为 g.
(2)碱性调味液中碳酸钠的质量分数为多少?(写出计算过程)
【实验二】
某同学在上述第Ⅲ组反应后的溶液中加足量硝酸银溶液,根据沉淀的质量计算出碱性调味液中氯化钠的质量分数请指出错误原因 ..
【实验一】
取三份碱性调味液各100g,分别缓慢加入到20g、40g和60g某盐酸中,测得三组实验数据见下表(气体的溶解忽略不计):
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 盐酸的质量/g | 20 | 40 | 60 |
| 生成气体的质量/s | 2.2 | 4.4 | 5.5 |
(1)100g碱性调味液与盐酸完全反应生成气体的质量为
(2)碱性调味液中碳酸钠的质量分数为多少?(写出计算过程)
【实验二】
某同学在上述第Ⅲ组反应后的溶液中加足量硝酸银溶液,根据沉淀的质量计算出碱性调味液中氯化钠的质量分数请指出错误原因
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据实验数据分析可知20克稀盐酸完全反应生成二氧化碳的质量,据此可算出60克稀盐酸完全反应生成二氧化碳的质量,进而根据第三组实验数据可知100g碱性调味液与盐酸完全反应生成气体的质量.
(2)根据二氧化碳的质量可算出碳酸钠的质量,再根据
×100%可求出碱性调味液中碳酸钠的质量分数.
【实验二】根据生成氯化银的质量包括了与碳酸钠与盐酸反应生成氯化钠的质量和过量盐酸反应生成的氯化银质量进行解答.
(2)根据二氧化碳的质量可算出碳酸钠的质量,再根据
| 碳酸钠的质量 |
| 碱性调味液的质量 |
【实验二】根据生成氯化银的质量包括了与碳酸钠与盐酸反应生成氯化钠的质量和过量盐酸反应生成的氯化银质量进行解答.
解答:解:(1)根据前两组实验数据分析可知每20克盐酸完全反应生成2.2克二氧化碳,则60克盐酸完全反应应生成6.6克二氧化碳,在第三组实验中加入60克盐酸只生成5.5克二氧化碳,说明第三组实验中盐酸有剩余,碳酸钠反应完,所以100g碱性调味液与盐酸完全反应生成气体的质量为5.5克.故答案为:5.5;
(2)设与盐酸反应的碳酸钠的质量为x.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 5.5g
=
x=13.25g
碱性调味液中碳酸钠的质量分数=
×100%=13.25%
答:碱性溶液中碳酸钠的质量分数为13.25%.
【实验二】生成氯化银的质量包括了与碳酸钠与盐酸反应生成氯化钠的质量和过量盐酸反应生成的氯化银质量,所以不能根据沉淀的质量计算出碱性调味液中氯化钠的质量分数.故答案为:生成氯化银的质量包括了与碳酸钠与盐酸反应生成氯化钠的质量和过量盐酸反应生成的氯化银质量.
(2)设与盐酸反应的碳酸钠的质量为x.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 5.5g
| 106 |
| x |
| 44 |
| 5.5g |
x=13.25g
碱性调味液中碳酸钠的质量分数=
| 13.25g |
| 100g |
答:碱性溶液中碳酸钠的质量分数为13.25%.
【实验二】生成氯化银的质量包括了与碳酸钠与盐酸反应生成氯化钠的质量和过量盐酸反应生成的氯化银质量,所以不能根据沉淀的质量计算出碱性调味液中氯化钠的质量分数.故答案为:生成氯化银的质量包括了与碳酸钠与盐酸反应生成氯化钠的质量和过量盐酸反应生成的氯化银质量.
点评:解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
“同呼吸,共奋斗”是2013年世界环境日的中国主题.大气中PM2.5(指大气中直径不超过2.5μm的颗粒物)的增多会导致灰霾天气,对人体健康和环境质量的影响较大.下列措施中不利于PM2.5治理的是( )
| A、加强建筑工地扬尘控制 |
| B、研发新能源汽车 |
| C、禁止焚烧秸秆 |
| D、发展燃煤发电 |
下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
( )
( )
A、C
| |||||||
B、Cu
| |||||||
C、CaO
| |||||||
D、Fe
|
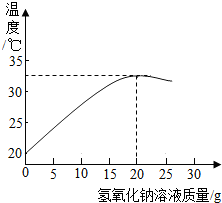 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.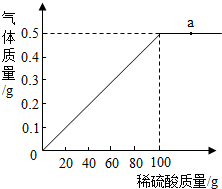 黄铜是以中国是铜锌合金,可用来制造机器、电器零件及日常用品.现取40g黄铜样品,向其中加入稀硫酸,反应生成的气体与所加稀硫酸的质量关系如图所示.
黄铜是以中国是铜锌合金,可用来制造机器、电器零件及日常用品.现取40g黄铜样品,向其中加入稀硫酸,反应生成的气体与所加稀硫酸的质量关系如图所示. 2013年12月,“嫦娥三号”探测器首次实现软着陆和月面巡视勘察.
2013年12月,“嫦娥三号”探测器首次实现软着陆和月面巡视勘察.