题目内容
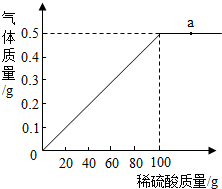 黄铜是以中国是铜锌合金,可用来制造机器、电器零件及日常用品.现取40g黄铜样品,向其中加入稀硫酸,反应生成的气体与所加稀硫酸的质量关系如图所示.
黄铜是以中国是铜锌合金,可用来制造机器、电器零件及日常用品.现取40g黄铜样品,向其中加入稀硫酸,反应生成的气体与所加稀硫酸的质量关系如图所示.(1)a点溶液中的主要离子是
(2)请计算该稀硫酸中溶质的质量分数;
(3)配制200g该稀硫酸,需49%的硫酸
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)由图象可知.a点是稀硫酸过量,溶液中的溶质有硫酸锌和硫酸来解答;
(2)根据化学方程式中氢气和硫酸的质量比来解答;
(3)根据溶液稀释时溶质的质量不变来解答.
(2)根据化学方程式中氢气和硫酸的质量比来解答;
(3)根据溶液稀释时溶质的质量不变来解答.
解答:(1)由图象可知.a点是稀硫酸过量,溶液中的溶质有硫酸锌和硫酸,故溶液中的离子有H+,Zn2+,
;
(2)设,100g稀硫酸中溶质质量为x,
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.5g
=
x=24.5g
稀硫酸中溶质的质量分数:
×100%=24.5%
(3)设,配制200g该稀硫酸,需49%的硫酸的质量为y,
200g×24.5%=x?49%
x=100g
答:(1)a点溶液中的主要离子是H+,Zn2+,
;
(2)稀硫酸中溶质的质量分数24.5%;
(3)配制200g该稀硫酸,需49%的硫酸100g.
| SO | 2- 4 |
(2)设,100g稀硫酸中溶质质量为x,
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.5g
| 98 |
| x |
| 2 |
| 0.5g |
x=24.5g
稀硫酸中溶质的质量分数:
| 24.5g |
| 100g |
(3)设,配制200g该稀硫酸,需49%的硫酸的质量为y,
200g×24.5%=x?49%
x=100g
答:(1)a点溶液中的主要离子是H+,Zn2+,
| SO | 2- 4 |
(2)稀硫酸中溶质的质量分数24.5%;
(3)配制200g该稀硫酸,需49%的硫酸100g.
点评:本题难度不是很大,利用图象可以看出生成氢气的质量是解答本题的突破口.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列用品,利用有机合成高分子材料的是 ( )
A、 景泰蓝花瓶 景泰蓝花瓶 |
B、 塑料手机套 塑料手机套 |
C、 橡胶手套 橡胶手套 |
D、 不锈钢剪刀. 不锈钢剪刀. |
 含碳物质在自然界种类繁多,性质各异.
含碳物质在自然界种类繁多,性质各异. 如图为A.B.C.三种物质的溶解度曲线.
如图为A.B.C.三种物质的溶解度曲线.