题目内容
14.20℃时氯化钠的溶解度为36g,该温度下,将12g氯化钠放入50g水中,充分溶解,溶液的溶质质量分数为19.4%,若将25g氯化钠放入50g水中,充分溶解,溶液的溶质质量分数为26.5%,形成的溶液是饱和(饱和或不饱和)溶液.(计算结果保留至0.1%)分析 20℃时氯化钠的溶解度为36g,其涵义是:20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态;据此判断20℃时将12、20克氯化钠放入到50克水中溶解的质量,进而计算出所得溶液的溶质的质量分数.
解答 解:20℃时氯化钠的溶解度为36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态,该温度下,将12g氯化钠放入50g水中,充分溶解,最多能溶解18g,充分搅拌后所得溶液的溶质的质量分数为$\frac{12g}{12g+50g}×$100%≈19.4%.
该温度下,若将20g氯化钠放入50g水中,充分溶解,最多只能溶解18g,形成的是饱和溶液,溶液的溶质质量分数为$\frac{18g}{18g+50g}$×100%≈26.5%.
故答案为:19.4%;26.5%;饱和.
点评 本题难度不大,理解溶解度的概念,熟练掌握溶质质量分数的有关计算是正确解答本题的关键.

练习册系列答案
相关题目
19. 氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应.如图所示,关于这两个反应的叙述正确的是( )
氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应.如图所示,关于这两个反应的叙述正确的是( )
 氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应.如图所示,关于这两个反应的叙述正确的是( )
氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应.如图所示,关于这两个反应的叙述正确的是( )| A. | 都发光发热 | B. | 生成物都是固体 | ||
| C. | 都产生蓝紫色火焰 | D. | 都是非金属和氧气反应 |
6.四只烧杯中分别盛有稀盐酸,并滴加了数滴石蕊试液.现向这四只烧杯中不断加入下列物质,直至过量,其中能使溶液最后呈紫色的物质是( )
| A. | Na2SO4 | B. | Zn (OH)2 | C. | Na2O | D. | KOH |
4.实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如图所示几个实验.得知:Na2CO3溶液和澄清石灰水都呈碱性(pH>7),CaCl2溶液呈中性(pH=7).
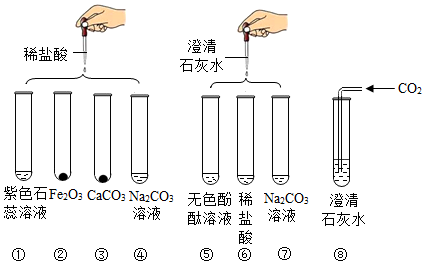
(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(2)实验后某试管中为红色溶液,向其中加入足量的稀盐酸,溶液变为无色.由此推断,该试管中最初盛有的物质是无色酚酞试液.
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现.由此推断,该试管中最初发生反应的化学方程为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(4)实验某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象.由此推断,该试管中最初发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,其反应类型为复分解反应.
(5)实验结束后,某同学将⑤⑥⑦三个试管的废液倒入同一个烧杯中,观察到废液呈浑浊并显红色,由此分析可知:
①废液中除碳酸钙、氯化钠、水和指示剂外,一定还含有氢氧化钠.
②依据上述实验过程,你认为引起废液呈碱性的物质组成共有3种可能.
③为了进一步探究废液的成分,该同学进行以下实验:

(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(2)实验后某试管中为红色溶液,向其中加入足量的稀盐酸,溶液变为无色.由此推断,该试管中最初盛有的物质是无色酚酞试液.
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现.由此推断,该试管中最初发生反应的化学方程为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(4)实验某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象.由此推断,该试管中最初发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,其反应类型为复分解反应.
(5)实验结束后,某同学将⑤⑥⑦三个试管的废液倒入同一个烧杯中,观察到废液呈浑浊并显红色,由此分析可知:
①废液中除碳酸钙、氯化钠、水和指示剂外,一定还含有氢氧化钠.
②依据上述实验过程,你认为引起废液呈碱性的物质组成共有3种可能.
③为了进一步探究废液的成分,该同学进行以下实验:
| 步骤 | 操作 | 现象 | 结论 |
| 第一步 | 取样,加入少量盐酸 | 无气泡产生 | 废液中一定没有碳酸钠 |
| 第二步 | 再次取样,进行实验⑧ | 无白色沉淀产生 | 废液中只有氢氧化钠 |
 利用如图所示装置探究CO2能与水反应.
利用如图所示装置探究CO2能与水反应. “空气中氧气含量的测定”有多种方法.甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
“空气中氧气含量的测定”有多种方法.甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
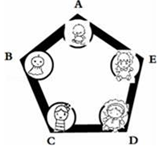 兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)
兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)