题目内容
4.将12.5g大理石放入100g稀盐酸中,大理石主要成分碳酸钙与盐酸恰好完全反应(杂质不反应也不溶解),过滤得到不饱和溶液和2.5g滤渣.试计算:(1)大理石中碳酸钙的质量分数;
(2)反应后所得溶液中溶质的质量分数.(结果精确至0.1%)
分析 因为反应时杂质不会参与反应,所以恰好反应后剩余的杂质即为大理石中杂质的质量,据此可知样品中碳酸钙的质量;利用方程式以及碳酸钙的质量可以求出生成氯化钙的质量;根据生成的氯化钙质量以及所得溶液的质量即可求出反应后所得溶液中溶质的质量分数.
解答 解:(1)根据反应后杂质的质量为5g,所以大理石中碳酸钙的质量为12.5g-2.5g=10.0g,则大理石中碳酸钙的质量分数为:$\frac{10.0g}{12.5g}$×100%=80%;
(2)设生成的氯化钙的质量是y,二氧化碳的质量是x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
10g y x
$\frac{100}{10g}=\frac{111}{y}=\frac{44}{x}$
x=4.4g y=11.1g
反应后所得溶液的质量是10g+100g-4.4g=105.6g,则反应后所得溶液中溶质的质量分数为 $\frac{11.1g}{105.6g}$×100%≈10.5%.
答:(1)大理石中碳酸钙的质量分数为80%;(2)反应后所得溶液中溶质的质量分数为10.5%.
点评 根据反应的化学方程式进行计算时,所使用的质量均为纯净物的质量,不纯物质的质量不能直接代入化学方程式进行计算.

练习册系列答案
相关题目
20.下列归纳和总结完全正确的一组是( )
| A化学与生活 | B化学与安全 |
| ①用洗涤剂去除油污 ②用镶有金刚石的玻璃刀裁玻璃 ③用生石灰作食品干燥剂 | ①炒菜锅着火可以用锅盖盖火 ②在室内一盆水能防止煤气中毒 ③夜间发现液化气泄漏开灯寻找泄漏源 |
| C化学与资源 | D化学与发现 |
| ①防止金属腐蚀是保护金属资源的途径之一 ②煤、石油、天然气是可再生能源 ③海洋中蕴藏着丰富的化学资源 | ①波义耳发现酸碱指示剂 ②拉瓦锡发现元素周期律并编制元素周期表 ③门捷列夫发现空气的组成 |
| A. | A | B. | B | C. | C | D. | D |
7.关于食盐水的描述,正确的是( )
| A. | 食盐是溶质,水是溶剂 | B. | 食盐是溶剂,水是溶质 | ||
| C. | 食盐水是溶剂,水是溶质 | D. | 水是溶质,食盐水是溶液 |
16.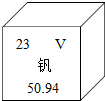 钒被誉为“合金的维生素”,钒元素的相关信息如图所示.下列有关钒的说法不正确的是( )
钒被誉为“合金的维生素”,钒元素的相关信息如图所示.下列有关钒的说法不正确的是( )
 钒被誉为“合金的维生素”,钒元素的相关信息如图所示.下列有关钒的说法不正确的是( )
钒被誉为“合金的维生素”,钒元素的相关信息如图所示.下列有关钒的说法不正确的是( )| A. | 属于金属元素 | B. | 原子序数为23 | ||
| C. | 原子核外电子数为23 | D. | 相对原子质量为50.94g |
13.取含铁、氧两种元素的固体样品11.6g,通入足量的CO并充分加热,将产生的气体通入足量澄清石灰水中,充分反应后,得到沉淀20.0g,该固体的组成可能是( )
| A. | Fe3O4 | B. | Fe3O4和Fe2O3 | ||
| C. | Fe和Fe2O3且质量比为7:20 | D. | FeO和Fe2O3且质量比为9:20 |
14.在硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定量铁粉,反应停止后过滤,滤液仍为蓝色.有关判断正确的是( )
| A. | 滤渣中一定有银和铁,可能有铜 | |
| B. | 滤渣中一定有银,一定没有铜和铁 | |
| C. | 滤液中一定有硝酸镁、硝酸亚铁、硝酸铜、硝酸银 | |
| D. | 滤液中一定有硝酸镁、硝酸亚铁、硝酸铜、可能有硝酸银 |