题目内容
9.实验是学习化学的一条重要途径.请结合如图1回答有关问题: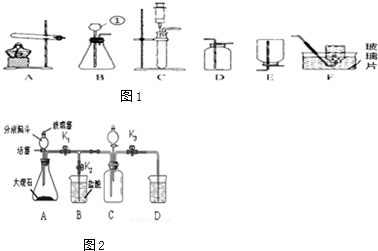
(1)写出实验仪器①的名称:长颈漏斗.
(2)实验室常用氯酸钾制取氧气,写出该反应的化学方程式:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,若要收集较为纯净的氧气,应选择的收集装置是F(填字母).
(3)实验室制取氧气时,若想要控制反应速率,应选择的发生装置C(填字母).
(4)某小组用如图2所示装置进行以下实验.①收集一瓶二氧化碳:打开止水夹K1和K3,关闭K2,从分液漏斗向装置A中加入足量的稀盐酸,写出A中化学方程式2HCl+CaCO3=CaCl2+H2O+CO2↑;当看到D中澄清石灰水变浑浊时,已集满.
②证明二氧化碳与氢氧化钠发生了化学反应:关闭止水夹K1和K3,打开K2,从分液漏斗向装置C中加入适量滴有酚酞的氢氧化钠溶液,直至实验结束,请写出此过程中C中发生的反应中一个化学方程式2NaOH+CO2═Na2CO3+H2O,或Na2CO3+2HCl═2NaCl+H2O+CO2↑.C中观察到的现象中,能证明CO2与NaOH确实发生了化学反应的现象是有气泡产生.
分析 (1)根据仪器的名称进行分析;
(2)利用二氧化锰作催化剂加热氯酸钾制氧气书写化学方程式;
(3)根据用注射器代替长颈漏斗可以较好地控制反应速率进行分析;
(4)①根据图示收集一瓶二氧化碳可知:要打开止水夹K1和K3、关闭K2,根据书写化学方程式的步骤:写配注等,正确书写化学方程式;
②根据二氧化碳的化学性质解答,根据压强原理进行推理,正确书写化学方程式.
解答 解:(1)实验仪器①的名称是长颈漏斗;故填:长颈漏斗;
(2)用二氧化锰作催化剂加热氯酸钾制氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
要收集较为纯净的氧气,应选择排水法收集,故收集装置F.
(3)实验室用大理石和稀盐酸反应制取二氧化碳,用注射器代替长颈漏斗可以较好地控制反应速率,可选用的发生装置是C;
(4)①打开止水夹K1和K3、关闭K2,从分液漏斗向装置A中加入足量的稀盐酸,稀盐酸与A中大理石反应生成二氧化碳,此时装置A中发生反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;当出现D中石灰水变浑浊现象时,说明二氧化碳已经收集满;
②关闭K1和K3,打开止水夹K2,从分液漏斗向装置C中加入适量滴有酚酞的氢氧化钠溶液,集气瓶中的二氧化碳与氢氧化钠反应,装置C中反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O;锥形瓶中的二氧化碳与氢氧化钠反应,压强变小,B装置中的压强大,就会将烧杯内的盐酸流入C中,然后盐酸与反应生成的碳酸钠反应,生成二氧化碳,因此有气泡生成;
故填:①2HCl+CaCO3=CaCl2+H2O+CO2↑;变浑浊;
②2NaOH+CO2═Na2CO3+H2O,或Na2CO3+2HCl═2NaCl+H2O+CO2↑,产生气泡.
故答案为:
(1)长颈漏斗;
(2)2 KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2 KCl+3O2↑;F;
(3)C;
(4)①2HCl+CaCO3=CaCl2+H2O+CO2↑;变浑浊;
②NaOH+HCl═NaCl+H2O 或Na2CO3+2HCl=2NaCl+H2O+CO2↑;有气泡产生.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 如图所示,加热烧瓶中的水使之沸腾.水蒸气从铜管喷出,把火柴靠近管口B处,火柴被加热,迅速移开火柴,火柴开始燃烧.下列说法错误的是( )
如图所示,加热烧瓶中的水使之沸腾.水蒸气从铜管喷出,把火柴靠近管口B处,火柴被加热,迅速移开火柴,火柴开始燃烧.下列说法错误的是( )| A. | 该实验说明火柴的着火点不超过100℃ | |
| B. | B处水蒸气的作用是使火柴温度达到着火点 | |
| C. | 火柴移离水蒸气,与氧气充分接触,从而燃烧 | |
| D. | 水沸腾后,水分子的间隔质量和体积都增大 |
| A. |  灭火焰 | B. |  闻气味 | C. |  读体积 | D. |  测水温 |
| A. |  检查装置气密性 | B. |  除去CO中水蒸气 | C. |  测定溶液pH | D. |  稀释浓硫酸 |
| A. | 向某固体中加入稀盐酸有气泡产生,可证明该物质中一定含有CO32- | |
| B. | 常温下可用Fe与AgCl反应制取Ag | |
| C. | 可用过量的Cu(OH)2除去CuSO4溶液中少量的H2SO4 | |
| D. | 将Fe(OH)3加入到滴有酚酞试液的蒸馏水中,溶液显红色 |
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 氢氧化钠固体 | D. | 碳酸钙 |

