题目内容
13.下列物质中含有的原子数最多的是( )| A. | 0.2mol氨气 | B. | 32g二氧化硫 | ||
| C. | 6.02×1022个硫酸分子 | D. | 64g铜 |
分析 1mol任何物质都含有阿伏加德罗常数个粒子,即1mol任何物质中含有6.02×1023个粒子,据此结合物质的微观构成,进行分析判断.
解答 解:A、氨气是由氨分子构成的,1个氨分子中含有4个原子,则0.2mol氨气中含有0.2mol×6.02×1023个×4=4.816×1023个原子.
B、二氧化硫的相对分子质量为64,二氧化硫的摩尔质量为64g/mol,32g二氧化硫的物质的量为32g÷64g/mol=0.5mol.1个二氧化硫分子中含有3个原子,32g二氧化硫中含有0.5mol×6.02×1023个×3=9.03×1023个原子.
C、1个硫酸分子中含有7个原子,6.02×1022个硫酸分子中含有6.02×1022个×7=4.214×1023个原子.
D、铜是由铜原子直接构成的,铜的相对原子质量为64,铜的摩尔质量为64g/mol,64g铜的物质的量为64g÷64g/mol=1mol.含有6.02×1023个原子.
故含有的原子数最多的是B.
故选:B.
点评 本题难度不大,主要考查物质的质量、物质的量与分子数目之间的换算关系,掌握质量、物质的量之间的换算关系是解决本题的关键.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
1.下列图象与相应操作对应正确的是( )
| A. |  两份完全相同的过氧化氢在有无催化剂情况下制氧气 | |
| B. | 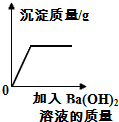 往稀盐酸和CuSO4的混合溶液中加入Ba(OH)2溶液 | |
| C. | 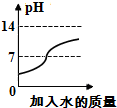 往稀盐酸中加水 | |
| D. | 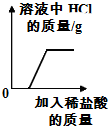 往碳酸钠溶液中加入稀盐酸 |
18. 已知:①CO2+H2O+Na2CO3=2NaHCO3;
已知:①CO2+H2O+Na2CO3=2NaHCO3;
②某些含钠元素的化合物在20℃时的溶解度如下表:
(1)实验室选用如图所示装置,用大理石和稀盐酸反应制取CO2,盐酸应该通过长颈漏斗(填仪器名称)添加到相应的反应器中,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2+H2O.用该方法制得的CO2气体中含有少量水蒸气及杂质气体.为得到纯净、干燥的CO2气体,应先将混合气体通过盛有C(选填A、B、C、D、E字母,下同)的洗涤装置,然后,再将气体通过盛有E的洗涤装置.
A.氯化钠饱和溶液 B.碳酸钠饱和溶液 C.碳酸氢钠饱和溶液 D.水 E.浓硫酸
(2)现向20℃时100.00g 13.25%的碳酸钠溶液中通入足量的CO2.
①最终得到碳酸氢钠的总质量为21g;
②列式计算最后所得溶液中碳酸氢钠的质量.
 已知:①CO2+H2O+Na2CO3=2NaHCO3;
已知:①CO2+H2O+Na2CO3=2NaHCO3;②某些含钠元素的化合物在20℃时的溶解度如下表:
| 物质 | 碳酸钠 | 碳酸氢钠 | 氢氧化钠 |
| 溶解度 | 21.8g | 9.6g | 109.0g |
A.氯化钠饱和溶液 B.碳酸钠饱和溶液 C.碳酸氢钠饱和溶液 D.水 E.浓硫酸
(2)现向20℃时100.00g 13.25%的碳酸钠溶液中通入足量的CO2.
①最终得到碳酸氢钠的总质量为21g;
②列式计算最后所得溶液中碳酸氢钠的质量.
5.实验室用过氧化氢溶液100克与3克的二氧化锰制氧气,完全反应后剩余固液混合物99.3克,求原过氧化氢溶液中氢元素的质量分数( )
| A. | 4.8% | B. | 10.7% | C. | 85.6% | D. | 10.2% |
11.推理是一种重要的学习方法,下列推理正确的是( )
| A. | 单质中只含有一种元素,所以只含有一种元素的物质就是单质 | |
| B. | 酸雨的pH<7,所以pH<7的降水就是酸雨 | |
| C. | 置换反应生成单质和化合物,所以能生成单质和化合物的反应就是置换反应 | |
| D. | 淀粉和碘酒能呈现蓝色,所以滴加碘酒能呈现蓝色的物质一定含有淀粉 |

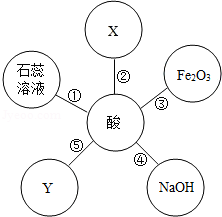 有不同之点.如图体现了酸类物质的化学性质,其中X、Y及图中所给其他物质的类别不同.结合此图回答下列问题.
有不同之点.如图体现了酸类物质的化学性质,其中X、Y及图中所给其他物质的类别不同.结合此图回答下列问题.