题目内容
13.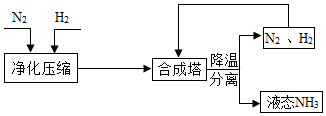 工业上合成 NH 3 的工艺流程可简化为:
工业上合成 NH 3 的工艺流程可简化为:(1)工业上制取 N2 时所用的廉价、易得的原料是空气;
(2)用焦炭和水蒸气制取氢气的反应过程为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,CO+H2O$\frac{\underline{\;高温\;}}{\;}$ CO2+H2
其中发生还原反应的物质是水;
(3)在高温、高压、催化剂存在的条件下,生成 NH3的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
(4)将降温分离出的 N 2、H 2 送回合成塔的目的是A;
A. 充分利用原料 B. 防止氮气污染空气.
分析 (1)工业上制取 N2 时所用的廉价、易得的原料是空气,这是因为空气中含有大量氮气;
(2)反应过程中,化合价升高的物质发生氧化反应,化合价降低的物质发生还原反应;
(3)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(4)将降温分离出的 N 2、H 2 送回合成塔的目的是充分利用原料.
解答 解:(1)工业上制取 N2 时所用的廉价、易得的原料是空气,这是因为空气中含有大量氮气.
故填:空气.
(2)C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2中,碳中的碳元素化合价升高,发生氧化反应,水中的氢元素化合价降低,发生了还原反应,CO+H2O$\frac{\underline{\;高温\;}}{\;}$ CO2+H2中,一氧化碳中的碳元素化合价升高,发生了氧化反应,水中的氢元素化合价降低,发生了还原反应,因此发生还原反应的物质是水.
故填:水.
(3)在高温、高压、催化剂存在的条件下,生成NH3的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
故填:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
(4)将降温分离出的 N 2、H 2 送回合成塔的目的是充分利用原料,不是为了防止氮气污染空气,这是因为氮气是空气的组成部分,不能污染空气.
故填:A.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
4.已知:草酸钙[CaC2O4]比碳酸钙受热易分解,CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑.将12.8gCaC2O4固体加热一段时间后剩余5.6g固体.下列说法正确的是( )
| A. | 剩余固体为混合物 | |
| B. | 剩余固体中含有钙元素的质量为4.0g | |
| C. | 将剩余固体溶于足量水中,其溶质质量为7.6g | |
| D. | 将加热产生的气体全部通入足量澄清石灰水中,生成5.0g固体 |
1.金属材料在生活、生产中应用广泛,下列说法正确的是( )
| A. | 不锈钢碗筷比普通铁锅耐腐蚀 | B. | 焊锡(锡铅合金)的熔点大于铅的熔点 | ||
| C. | 银导电性最好,常用作电线 | D. | 铁制品只要与水接触就会生锈 |
8.下列关于葡萄糖(C6H12O6)的说法中,错误的是( )
| A. | 属于有机物 | B. | 由三种元素组成 | ||
| C. | 每个分子中含有6个碳原子 | D. | 碳、氢、氧元素的质量比为1:2:1 |
18.在20℃时氯化钠的溶解度为36g,则在此温度下的氯化钠饱和溶液里,下列相互之间的质量比例关系正确的是( )
| A. | 溶质:溶液=9:25 | B. | 溶质:溶液=9:26 | C. | 溶剂:溶质=25:9 | D. | 溶液:溶剂=17:8 |

 构建模型和构建知识网络是学习化学重要的学习方法,小军同学利用左手构建酸的化学性质知识网络,如图所示(其中A、B表示与酸反应的
构建模型和构建知识网络是学习化学重要的学习方法,小军同学利用左手构建酸的化学性质知识网络,如图所示(其中A、B表示与酸反应的