题目内容
16.最近几年冬天温江经常发生雾霾和酸雨,对环境污染较为严重.大量燃烧含硫量高的煤和各种机动车排放的尾气,是形成雾霾和酸雨的重要原因.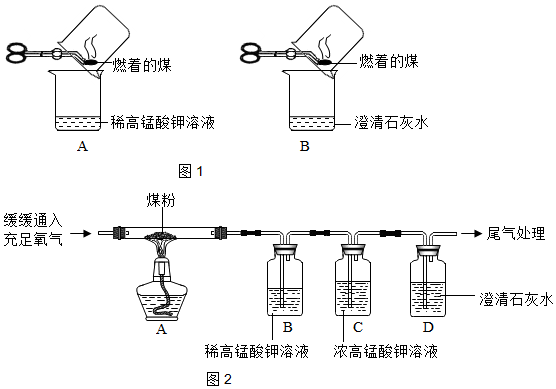
【提出问题】通过实验证明煤中含有碳元素和硫元素.
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2X”这个化学方程式中物质X的化学式是H2SO4.
(2)“二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊.”请写出二氧化硫与澄清石灰水反应的化学方程式:SO2+Ca(OH)2═CaSO3↓+H2O.
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行了探究,
【探究和分析】
(3)甲同学进行了如图1所示A、B两步实验.
现象:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.
结论:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.
(4)乙同学认为甲同学的结论中生成CO2不合理,其理由是二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素.
(5)丙同学:”实验操作“:丙同学进行了如图2所示实验(部分装置在图中略去)证明CO2和SO2的生成:
【反思与表达】(6)上图中C装置的作用是除去过多的二氧化硫或排除二氧化硫的干扰.
(7)丙同学的实验中要证明煤中含有碳元素和硫元素的现象是B中溶液褪色,C中溶液不褪色,D中溶液变浑浊.
分析 (1)根据质量守恒定律考虑;
(2)根据氢氧化钙和二氧化硫反应生成亚硫酸钙和水进行分析;
(4)根据二氧化硫的特点考虑;
(6)根据主要是验证二氧化硫是否被除尽或排除二氧化硫的干扰;进行尾气处理的目的防止污染空气解答;
(7)根据二氧化硫和二氧化碳都是酸性氧化物,均可以和氢氧化钙之间发生反应的性质,要先验证二氧化硫再除去二氧化硫再验证二氧化碳.
解答 解:(1)根据反应的化学方程式5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X及质量守恒定律(反应前后各原子种类和数目不变)判断:反应前5SO2、2KMnO4、2H2O中共含有5个硫原子、2个钾原子、2个锰原子、20个氧原子、4个氢原子,反应后K2SO4、2MnSO4中共含有3个硫原子、2个钾原子、2个锰原子、12个氧原子、0个氢原子,2X中应含有4个氢原子、2个硫原子、8个氧原子;一个X分子中应含有2个氢原子、1个硫原子、4个氧原子,所以这个化学方程式中最后一种物质X的化学式是H2SO4;
(2)氢氧化钙和二氧化硫反应生成亚硫酸钙和水,化学方程式为:SO2+Ca(OH)2═CaSO3↓+H2O;
(4)由于二氧化硫也能使石灰水变浑浊,所以不能判断含有碳元素;
(6)主要是验证二氧化硫是否被除尽或排除二氧化硫的干扰;
(7)二氧化硫的检验用品红,二氧化硫会使之褪色,二氧化碳检验用澄清石灰水,检验二氧化碳之前先检验二氧化硫,再将之除尽,最后检验二氧化碳,二氧化碳能使石灰水变浑浊,故答案为:B中溶液褪色,C中溶液不褪色,D中溶液变浑浊.
故答案为:(1)H2SO4;
(2)SO2+Ca(OH)2═CaSO3↓+H2O;
(4)二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素;
(6)除去过多的二氧化硫或排除二氧化硫的干扰;
(7)B中溶液褪色,C中溶液不褪色,D中溶液变浑浊.
点评 本题以实验探究的形式,检验物质的存在和物质的性质.培养了学生的动手能力和动脑思考的能力.

| A. | 加过量氢氧化钠溶液,目的是除去Mg2+ | |
| B. | 加过量的碳酸钠溶液,目的是除去Ca2+ | |
| C. | 过滤后滤渣的成分是BaSO4、BaCO3、CaCO3、Mg(OH)2 | |
| D. | 加盐酸调至pH=7后,溶液中的溶质只含NaCl |
| 编号 | 实验事实 | 实验结论 |
| A | 某溶液使酚酞溶液变红 | 该溶液一定是NaOH溶液 |
| B | 某物质可以导电 | 该物质一定是金属单质 |
| C | 常温下,测定某溶液的pH=3 | 该溶液一定呈酸性 |
| D | 某气体不能使带火星的木条复燃 | 该气体一定不含氧气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 活性炭可除去水中的异味 | B. | 过滤可以除去水中所有的杂物 | ||
| C. | 硬水通过煮沸可降低硬度 | D. | 蒸馏对水的净化程度最高 |
| A. | 铁丝 | B. | 硫粉 | C. | 木炭 | D. | 红磷 |
| A. |  点燃酒精灯 点燃酒精灯 | B. |  | C. |  称量固体 称量固体 | D. |  |

 如图是A、B、C三种物质的溶解度曲线,请根据图回答:
如图是A、B、C三种物质的溶解度曲线,请根据图回答: