题目内容
10. 溶液具有导电性是因为溶液中存在着自由移动的离子,当接通电路时,这些自由移动的离子能定向移动,产生电流,而且在一定条件下,离子浓度越高,导电性就越强.某同学做了如下的实验:向硫酸溶液中逐渐滴加氢氧化钡溶液,并利用相应的仪器测定溶液的导电性,绘制如下的图.请回答下列的问题.
溶液具有导电性是因为溶液中存在着自由移动的离子,当接通电路时,这些自由移动的离子能定向移动,产生电流,而且在一定条件下,离子浓度越高,导电性就越强.某同学做了如下的实验:向硫酸溶液中逐渐滴加氢氧化钡溶液,并利用相应的仪器测定溶液的导电性,绘制如下的图.请回答下列的问题.(1)B点对应溶液的pH=7(填“<”“=”“>”);
(2)试解释导电性发生如此变化的原因.
分析 稀硫酸和氢氧化钡反应生成硫酸钡沉淀和水,纯净的水几乎不导电.
解答 解:(1)B点时导电性是0,说明硫酸和氢氧化钡恰好完全反应,对应液体是水,水的pH=7.
故填:=.
(2)导电性发生如此变化的原因是:随着氢氧化钡溶液的不断加入,硫酸不断反应,溶液中的自由移动的离子越来越少,导电性越来越差,当恰好完全反应时导电性是0,继续加入氢氧化钡溶液时,液体中自由移动的离子越来越多,导电性增强.
故答案为:随着氢氧化钡溶液的不断加入,硫酸不断反应,溶液中的自由移动的离子越来越少,导电性越来越差,当恰好完全反应时导电性是0,继续加入氢氧化钡溶液时,液体中自由移动的离子越来越多,导电性增强.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
16.下列各组物质的溶液,不用其他试剂,仅通过观察和用组内溶液相互混合的方法,不能将它们一一鉴别出来的是( )
| A. | Ba(OH)2、NaCl、Na2SO4、Na2CO3 | B. | NaCl、BaCl2、CuSO4、NaOH | ||
| C. | NaOH、Ca(OH)2、H2SO4、K2CO3 | D. | KNO3、HCl、Na2CO3、BaCl2 |
1.利用图1装置进行I、II两组实验,将滴管a中的液体滴入b中,待充分作用后,打开止水夹d.a、b、c中所加试剂如下表所示.(已知:HCl气体极易溶解于水.白磷的着火点为40℃.)
(1)实验I中,若在c中长导管口处放置一块白磷,当打开止水夹后,可观察到白磷燃烧,通过此实验能证明燃烧的条件是与氧气接触.若要证明燃烧的另一条件,在对比实验中,需将c中盛放的试剂改为冷水.
(2)实验II能证明NaOH与HCl发生了反应.实验过程中,打开止水夹d后,可观察到的现象为c中的氢氧化钠溶液倒吸入b中,b中红色溶液变成紫色或蓝色.
(3)若按图2所示连接装置,进行实验II,则会观察到c中长导管口有气泡产生,原因是b中氯化氢气体溶于水,导致瓶中气压减小,从而导致瓶外空气进入c中.
| 实验 | a中试剂 | b中试剂 | c中试剂 | 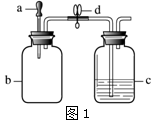 | 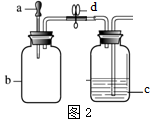 |
| I | 5%H2O2溶液 | MnO2 | 80℃热水 | ||
| II | 石蕊溶液 | HCl气体 | NaOH溶液 |
(2)实验II能证明NaOH与HCl发生了反应.实验过程中,打开止水夹d后,可观察到的现象为c中的氢氧化钠溶液倒吸入b中,b中红色溶液变成紫色或蓝色.
(3)若按图2所示连接装置,进行实验II,则会观察到c中长导管口有气泡产生,原因是b中氯化氢气体溶于水,导致瓶中气压减小,从而导致瓶外空气进入c中.
18.人类生活离不开空气.下列说法不正确的是( )
| A. | 空气的成分以氮气和氧气为主 | |
| B. | 空气中0.94%的稀有气体属于纯净物 | |
| C. | 氧气能供给呼吸,可用于医疗急救 | |
| D. | 氮气的化学性质不活泼,可用作保护气 |
19.下列对一些事实的解释错误的是( )
| 事 实 | 解释 | |
| A | 书写档案规定必须使用碳素墨水 | 常温下碳的化学性质稳定 |
| B | 石墨能够做电池的电极材料 | 石墨能够导电 |
| C | 焦炭可以把铁从它的氧化物矿石里还原出来 | 焦炭具有氧化性 |
| D | 制糖工业中用活性炭来脱色以制白糖 | 活性炭具有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
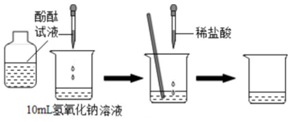
 某校化学小组在利用稀盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示.
某校化学小组在利用稀盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示.