题目内容
7.同学们做甲、乙两个中和反应实验的探究(见图1).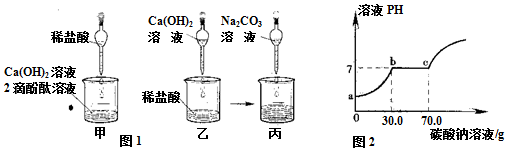
(1)甲实验恰好中和,则该溶液中的溶质是CaCl2(填化学式).
(2)取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图2所示.则与CaCl2反应的碳酸钠溶液的质量为40g;请计算原60.0g溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%).
(3)根据计算所得数据在图3中画出产生沉淀的曲线.
(4)乙组的中和反应实验设计存在的不足是无法验证是否恰好中和.
分析 (1)根据盐酸和氢氧化钙的反应进行分析;
(2)反应后的溶液是氯化钙溶液,和碳酸钠溶液反应生成碳酸钙沉淀,根据化学反应方程式进行分析计算;
(3)根据计算数据绘制曲线图即可;
(4)乙组的中和反应试验中没有加酚酞试液,无法验证是否恰好中和;
解答 解:(1)盐酸和氢氧化钙的反应生成氯化钙和水,恰好中和后,溶液中的溶质只有氯化钙,故答案为:CaCl2;
(2)由图可知,碳酸钠溶液的量到70g时,反应正好完成;氯化钙和碳酸钠的反应生成碳酸钙和水,据题意,设参加反应的CaCl2的质量为 x,则
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106
x 40g×26.5%
$\frac{111}{106}=\frac{x}{40g×26.5%}$
解得:x=11.1g
该CaCl2溶液的溶质质量分数为:$\frac{11.1g}{60g}$×100%=18.5%
故答案为:40;18.5%;
(3)由图丁可知乙反应后的溶液pH<7,说明溶液中仍有稀盐酸,直到滴加的Na2CO3溶液达到30.0g,稀盐酸被完全反应掉,Na2CO3溶液开始与CaCl2溶液反应,当滴加Na2CO3溶液到70.0g时,CaCl2溶液被完全反应掉.
设:滴加质量分数26.5%的Na2CO3溶液70g时(此时与CaCl2溶液反应的Na2CO3溶液质量为40g),生成沉淀的质量为x,则
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100
40g×26.5% x
$\frac{106}{100}=\frac{40g×26.5%}{x}$
解得:x=10.0g.
(4)乙组的中和反应试验中没有加酚酞试液,无法验证是否恰好中和;
故答案为:无法验证是否恰好中和.
点评 本题是一种综合性的题型,将溶液、化学反应和图象融合在一起,有一定的难度,要求比较高.通常学生在计算时常常会忽视了实际参加反应的是溶液中溶质的质量,而往往会把数据直接代入化学方程式进行计算.这就要求学生足够细心、会分析、且条理分明.

 名校课堂系列答案
名校课堂系列答案| A. | 一定存在CO32-与NH4+ | B. | 一定不存在Ba2+,可能存在NH4+ | ||
| C. | 一定不存在Na+ | D. | 一定不存在Cl- |
| A. | 20.58% | B. | 19.6% | C. | 98% | D. | 22.86% |
| A. | 80% | B. | 40% | C. | 15% | D. | 25% |
(已知:KHCO3+HCl=KCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O )
| A. | m1=m2 | |
| B. | 混合物A中CaCO3和KHCO3质量比一定为1:1 | |
| C. | 21ml=25m2 | |
| D. | 混合物B中MgCO3和NaHCO3质量比一定为1:1 |

| A. | 甲实验按照③②①的步骤,如图所示操作,配制的溶液浓度偏小 | |
| B. | 操作②中,若将食盐和砝码互换位置,配制的溶液浓度偏小 | |
| C. | 各步骤作中的玻璃棒都是用来搅拌 | |
| D. | 乙实验步骤是①④⑤,其中⑤当蒸发皿出现较多固体时,就应停止加热 |
 世园会植物馆号称亚洲第一大钢结构管,拼装钢材杆件达到14000多根,所有杆件均为现场拼装焊接.
世园会植物馆号称亚洲第一大钢结构管,拼装钢材杆件达到14000多根,所有杆件均为现场拼装焊接.
