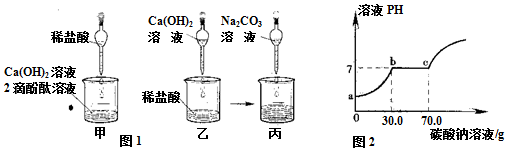
题目内容
2.表面部分被氧化的镁条2.6g,与某浓度的50g稀硫酸恰好完全反应,生成0.2g氢气.该稀硫酸的质量分数是( )| A. | 20.58% | B. | 19.6% | C. | 98% | D. | 22.86% |
分析 根据镁和硫酸反应会生成硫酸镁和氢气,氧化镁和硫酸反应会生成硫酸镁和水,结合题中所给的数据进行分析解答.
解答 解:(1)设参加反应的镁的质量为x,硫酸质量为y,
Mg+H2SO4=MgSO4+H2↑
24 98 2
x y 0.2g
$\frac{24}{x}=\frac{98}{y}=\frac{2}{0.2g}$
x=2.4g,y=9.8g
(2)所以氧化镁的质量为:2.6g-2.4g=0.2g,
与氧化镁反应的硫酸质量为z,
MgO+H2SO4=MgSO4+H2O
40 98
0.2g z
$\frac{40}{98}=\frac{0.2g}{z}$
z=0.49g
故该稀硫酸的质量分数是:$\frac{9.8g+0.49g}{50g}×100%$=20.58%
故选:A.
点评 在解此类题时,首先分析题中的反应原理,然后结合题中所给的数据进行解答.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
12.一杯10℃的硝酸钾溶液,能证明它是饱和溶液的方法是( )
| A. | 蒸发5克水有晶体析出 | B. | 把温度降到0℃有晶体析出 | ||
| C. | 加入极少量的硝酸钾不溶 | D. | 以上三种方法都可以 |
 下列是化学实验中常见的基本操作.据图回答下列问题:
下列是化学实验中常见的基本操作.据图回答下列问题: 钙是维持人体正常功能所必需的元素,如图为某种补钙剂“钙尔奇”说明书的一部分
钙是维持人体正常功能所必需的元素,如图为某种补钙剂“钙尔奇”说明书的一部分
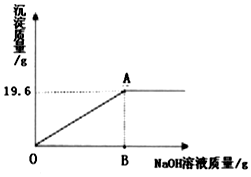 有一包固体粉末,可能是碳酸钙、硫酸钠、硫酸铜、碳酸钠中的一种或多种.某实验小组对其成分进行了探究活动.
有一包固体粉末,可能是碳酸钙、硫酸钠、硫酸铜、碳酸钠中的一种或多种.某实验小组对其成分进行了探究活动.