题目内容
16.某化学兴趣小组的同学对食品保鲜袋元素组成进行了如下研究.注:①碱石灰是由NaOH和CaO组成混合物,可以吸收二氧化碳和水;
②此处无水硫酸铜可作吸水剂,且吸水后由白色变为蓝色.
【提出猜想】保鲜袋可能由“碳、氢、氧”中的两种或三种元素组成.
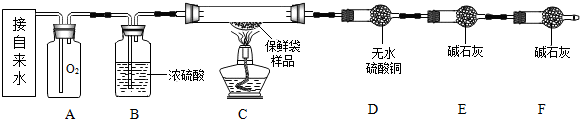
【实验设计】小组同学设计了如图实验装置,利用燃烧法测定保鲜袋的元素组成.
【实验步骤】
(1)按上图图示连接好仪器.
(2)检查装置的气密性.
(3)按图示装好药品和1.8g剪碎的保鲜袋样品,除D、E、F外将仪器按原图组装.
(4)向A中缓慢注水一段时间后,将已称重的D、E两干燥管和未称重的F干燥管接到C的尾端.(注:D、E称重质量分别为140g和180g)
(5)点燃C处的酒精灯,直至保鲜袋子碎片完全燃烧.
(6)熄灭酒精灯并继续向A中注水一段时间.
(7)充分吸收后,分别对D、E进行第2次称重.(注意:D、E称重质量分别为143.6g和184.4g)
【实验分析】
(1)B处的浓硫酸的作用是吸收水分.F处干燥管的作用防止空气中的水分和CO2进入E装置.
(2)在步骤上述(4)中要向A中缓慢注水一段时间是为了排出玻璃管C中的空气,将足量的氧气充入到C装置中,确保样品完全燃烧.
(3)熄灭酒精灯后继续向A中注水一段时间是为了使C中的水蒸气及CO2气体完全排出,被D、E装置充分吸收.
(4)则该食品保鲜袋的元素组成中是否含有氧元素有.(填“有”或“无”).理由是(143.6g-140g)×$\frac{2}{18}$+(184.4g-180g)×$\frac{12}{44}$=1.6g<1.8g(列算式说明.)
分析 (1)根据浓硫酸具有吸水性、碱石灰能吸收空气中的水分和二氧化碳分析作用;
(2)根据装置内含有空气且氧气的含量较低分析回答;
(3)根据装置内有残留的水蒸气和二氧化碳分析熄灭酒精灯后继续向A中注水一段时间的目的;
(4)根据质量守恒定律分析.
解答 解:(1)由于浓硫酸具有吸水性,B处的浓硫酸的作用是吸收水分;由于碱石灰能吸收空气的水分和二氧化碳,F处干燥管的作用防止空气中的水分和CO2进入E装置.
(2)由于装置内含有空气,氧气的含量较低,所以在步骤上述(4)中要向A中缓慢注水一段时间是:为了排出玻璃管C中的空气,将足量的氧气充入到C装置中,确保样品完全燃烧.
(3)由于装置内有残留的水蒸气和二氧化碳.所以,熄灭酒精灯后继续向A中注水一段时间是为了:使C中的水蒸气及CO2气体完全排出,被D、E装置充分吸收;
(4)由于氢元素和碳元素的质量之和为:(143.6g-140g)×$\frac{2}{18}$+(184.4g-180g)×$\frac{12}{44}$=1.6g<1.8g
所以含有氧元素.
故答为:(1)吸收水分,防止空气中的水分和CO2进入E装置.
(2)排出玻璃管C中的空气;将足量的氧气充入到C装置中,确保样品完全燃烧.
(3)使C中的水蒸气及CO2气体完全排出,被D、E装置充分吸收.
(4)有,(143.6g-140g)×$\frac{2}{18}$+(184.4g-180g)×$\frac{12}{44}$=1.6g<1.8g.
点评 本题考查了物质的组成和构成,注意宏观概念和微观概念描述上的差别,注意利用实验数据及其计算方法.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
6.下列材料属于合成材料的是( )
| A. | 羊毛 | B. | 水泥 | C. | 合金 | D. | 塑料 |
1.学习了CO2的有关知识后,同学们查阅资料发现Mg能在CO2中燃烧,反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$□X+C,关于物质X,下列说法正确的是( )
| A. | 该物质一定是氧化物 | |
| B. | 该物质的化学式为MgCO3 | |
| C. | 该物质中镁、氧元素的质量比为 1:1 | |
| D. | 该物质中氧元素的质量分数是25% |
8.填写下列物质(或主要成分)的化学式或其用途(只需写一条).
物质 |  |  |  |  |
| 化学式 | NaCl | C | NaHCO3 | CaO |
| 用途 | 做调味品、生理盐水、选种、化工原料、消除积雪等 | 切割大理石、做装饰品(钻石)等 | 做发酵粉 | 做干燥剂 |
5.向NaOH溶液中逐渐加入CuSO4溶液,测得的沉淀质量如表所示,请计算该CuSO4溶液中溶质的质量分数.
| CuSO4溶液 | 10g | 20g | 30g | 40g | 50g |
| 沉淀质量 | 0.49g | 0.98g | 1.47g | 1.96g | 1.96g |
8.燃煤产生的烟气中含有二氧化硫,直接排放会污染空气,某科研小组利用海水除去二氧化硫,其工艺流程见图:

请回答下列问题:
(1)二氧化硫排放到空气中,容易产生的环境问题是A(填序号).
A.酸雨 B.温室效应 C.白色污染 D.臭氧层空洞
(2)亚硫酸(H2SO3)易被空气中氧气氧化为硫酸,亚硫酸中硫的化合价是+4.
(3)用熟石灰中和稀硫酸的化学方程式是Ca(OH)2+H2SO4═CaSO4+2H2O.
(4)为了研究脱硫率与温度、烟气中SO2浓度的关系,他们进行了探究实验.实验结果如下:
由表中实验数据可得出的结论是浓度一定时,温度升高,脱硫率降低;温度一定时,烟气中SO2浓度升高,脱硫率降低.

请回答下列问题:
(1)二氧化硫排放到空气中,容易产生的环境问题是A(填序号).
A.酸雨 B.温室效应 C.白色污染 D.臭氧层空洞
(2)亚硫酸(H2SO3)易被空气中氧气氧化为硫酸,亚硫酸中硫的化合价是+4.
(3)用熟石灰中和稀硫酸的化学方程式是Ca(OH)2+H2SO4═CaSO4+2H2O.
(4)为了研究脱硫率与温度、烟气中SO2浓度的关系,他们进行了探究实验.实验结果如下:
| 实验序号 | 温度/℃ | 烟气中SO2浓度/10-2g•L-1 | 脱硫率/% |
| Ⅰ | 23 | 2.5% | 99.5 |
| Ⅱ | 23 | 3.2% | 97.1 |
| Ⅲ | 40 | 2.5% | 94.3 |