题目内容
7.如图是自来水消毒过程中发生反应的微观图,产物之一是次氯(HClO),具有杀菌消毒作用.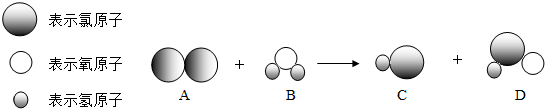
(1)下列 A、B、C、D 中代表次氯酸(HClO)的是D(填字母)
(2)该反应的化学方程式为Cl2+H2O═HCl+HClO.
(3)若通入142g的A物质可以生成次氯酸(HClO)105g.
(4)通过检验产物 C 来证明该反应已发生,方法是在反应后的溶液中滴入几滴 AgNO3溶液,有白色沉淀生成,用化学方程式表示其原理HCl+AgNO3═AgCl↓+HNO3.
分析 (1)根据物质的微观构成分析代表次氯酸(HClO)的图示;
(2)观察反应微观图,分析反应物、生成物,写出反应的化学方程式;
(3)根据方程式,由A物质的质量求出生成次氯酸的质量;
(4)根据盐酸与硝酸银的反应,写出反应的化学方程式.
解答 解:(1)由物质的微观构成可知,代表次氯酸(HClO)的是D.
(2)由自来水消毒过程中发生反应的微观图可知,该反应是氯气与水反应生成了盐酸和次氯酸,化学方程式为:Cl2+H2O═HCl+HClO.
(3)设生成的次氯酸的质量为x
Cl2+H2O═HCl+HClO
71 52.5
142g x
$\frac{71}{52.5}=\frac{142g}{x}$ 解得:x=105g
(4)盐酸能与硝酸银反应生成了氯化银白色沉淀和硝酸,化学方程式为:HCl+AgNO3═AgCl↓+HNO3.
故答为:(1)D;(2)Cl2+H2O═HCl+HClO;(3)105;(4)HCl+AgNO3═AgCl↓+HNO3.
点评 本题综合性较强,但由于问题较多,容易被弄糊涂了,因此要从概念的科学定义出发,逐一解答.对于方程式书写的解答要注意配平,不能光看图示,否则容易出错.

练习册系列答案
相关题目
17. 某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
【提出问题】金属与盐酸反应速率受哪些因素影响?
【猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关;c…
【设计探究】实验所用的金属均已用砂纸打磨.
实验A:为探究猜想a,小明同学分别在两支试管中放入相同质量的锌片和铁片,分别加入相同体积和浓度的稀盐酸,观察到盐酸与锌片反应比与铁片反应产生的气泡快,请写出其中的一个化学反应方程式Zn+2HCl=ZnCl2+H2↑;Fe+2HCl=FeCl2+H2↑.
从实验现象可以判断:金属活动性Zn> Fe(填“>”“<”或“=”).
【得出结论】金属与盐酸反应的速率与金属本身性质有关.金属活动性与反应的速率的关系是金属活动性越强,反应的程度越剧烈.
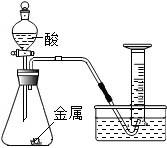
实验B:为探究猜想b,小明设计如图所示的装置进行实验,所用药品及实验数据如表:
得出结论:金属与盐酸发生反应的速率与盐酸的浓度有关,即盐酸浓度越大,反应程度越剧烈.
【反思评价】根据实验Ⅰ、Ⅱ数据分析,解释锌与盐酸反应速率快慢的变化原因锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.
【新猜想】通过以上探究,你认为金属与盐酸反应的速率度还可能受哪些因素影响.金属表面积.(写一条即可)
【继续探究】请对你提出的新猜想,设计实验证明,并总结出合理的结论.分别取相同质量的大颗锌粒和小颗锌粒,与相同浓度、相同质量的稀盐酸在相同温度下反应(控制其他因素不变),观察到小颗锌粒与酸反应速率快.结论:金属表面积越大,金属与酸反应的越快.
 某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:【提出问题】金属与盐酸反应速率受哪些因素影响?
【猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关;c…
【设计探究】实验所用的金属均已用砂纸打磨.
实验A:为探究猜想a,小明同学分别在两支试管中放入相同质量的锌片和铁片,分别加入相同体积和浓度的稀盐酸,观察到盐酸与锌片反应比与铁片反应产生的气泡快,请写出其中的一个化学反应方程式Zn+2HCl=ZnCl2+H2↑;Fe+2HCl=FeCl2+H2↑.
从实验现象可以判断:金属活动性Zn> Fe(填“>”“<”或“=”).
【得出结论】金属与盐酸反应的速率与金属本身性质有关.金属活动性与反应的速率的关系是金属活动性越强,反应的程度越剧烈.
实验B:为探究猜想b,小明设计如图所示的装置进行实验,所用药品及实验数据如表:
| 实验编号 | 选用金属 (均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 0~1min | 1~2min | 2~3min | 3~4min | 4~5min | 前5min共收集气体 | |||
| Ⅰ | 锌片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 47.6 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据实验Ⅰ、Ⅱ数据分析,解释锌与盐酸反应速率快慢的变化原因锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.
【新猜想】通过以上探究,你认为金属与盐酸反应的速率度还可能受哪些因素影响.金属表面积.(写一条即可)
【继续探究】请对你提出的新猜想,设计实验证明,并总结出合理的结论.分别取相同质量的大颗锌粒和小颗锌粒,与相同浓度、相同质量的稀盐酸在相同温度下反应(控制其他因素不变),观察到小颗锌粒与酸反应速率快.结论:金属表面积越大,金属与酸反应的越快.
15.从广义上说,有元素化合价改变的化学反应都叫氧化-还原反应.化学反应后若元素化合价升高的反应物成为还原剂,化学反应后若元素化合价降低的反应物称为氧化剂.则反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中还原剂是:( )
| A. | Al2O3 | B. | Fe | C. | Fe2O3 | D. | Al |
12.下列各组物质的区分方法中,不可行的是( )
| A. | 用稀盐酸区分铜和黄铜 | |
| B. | 用肥皂水区分硬水和软水 | |
| C. | 用水区分生石灰和硝酸铵固体 | |
| D. | 用酚酞溶液区分纯碱溶液和烧碱溶液 |
19.香菇是一种味道鲜美、营养丰富、散发着浓郁香气的蔬菜.经研究发现其香味的主要成分是香菇精( C8H4S5),下列有关说法正确的是( )
| A. | 香菇精分子是由C、H、S三种元素组成的 | |
| B. | 香菇精是由8个碳原子、4个氢原子和5个硫原子构成 | |
| C. | 香菇精中氢元素的质量分数最小 | |
| D. | 香菇精的相对分子质量为261 |