题目内容
1.实验室按下图所示装置制取CO2,并检验CO2的性质.试回答以下问题:问题.
(1)实验开始前,先应检查装置A的气密性.
(2)用装置A来制取CO2,所用的药品名称是大理石或石灰石与稀盐酸;反应的化学方程式:CaCO3+2HCl═CO2↑+H2O+CaCl2.
(3)若要用装置B检验CO2,在B中应盛放的试剂名称是澄清石灰水,当将标①和②的导管口连接时,B中看到的实验现象是澄清石灰水变浑浊.
(4)若要用装置C证明CO2能与水反应生成碳酸,C中除有少量水外,应加入的试剂是紫色石蕊试液,当将标①和③的导管口连接时,C中看到的实验现象是紫色石蕊试液变红.
(5)烧杯D中放有燃着的蜡烛如图所示,当将标①和④的导管口连接时,D中下层蜡烛先熄灭,上层蜡烛后熄灭,这说明二氧化碳密度比空气大,且不能燃烧、不能支持燃烧.
(6)继续设计并进行有关CO2性质的探究实验,如装置E、F.先在装置E中放一个用空气充胀的气球,制取一瓶二氧化碳倒入E装置后,出现如F装置实验现象.请回答:该实验的目的是探究CO2的密度比空气大.
分析 (1)根据实验室制取二氧化碳气体的实验步骤,进行分析解答.
(2)实验室制取二氧化碳用石灰石或大理石和稀盐酸反应制取,石灰石或大理石的主要成分是碳酸钙,据此解答;
(3)根据检验CO2应用澄清的石灰水,进行分析解答;
(4)二氧化碳与水反应生成碳酸,结合碳酸能使紫色石蕊溶液变红,进行分析解答;
(5)根据实验现象来分析解答;
(6)结合图示分析实验目的.
解答 解:(1)实验开始前,先应检查装置A的气密性,然后再装入药品,以避免装入药品后发现装置气密性不好,更换部分仪器而浪费药品.故填:气密性;
(2)实验室制取二氧化碳用大理石或石灰石和稀盐酸反应制取,石灰石或大理石的主要成分是碳酸钙,它们反应的化学方程式为:CaCO3+2HCl═CO2↑+H2O+CaCl2;故填:大理石或石灰石与稀盐酸;CaCO3+2HCl═CO2↑+H2O+CaCl2;
(3)若要用装置B检验CO2,在B中应盛放的试剂名称是澄清石灰水;当将标①和②的导管口连接时,二氧化碳与石灰水反应生成碳酸钙沉淀和水,B中看到的实验现象是澄清石灰水变浑浊;故填:澄清石灰水;澄清石灰水变浑浊;
(4)二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变红,若要用装置C证明CO2能与水反应生成碳酸,C中除有少量水外,应加入的试剂是紫色石蕊试液;当将标①和③的导管口连接时,C中看到的实验现象是紫色石蕊试液变红;故填:紫色石蕊试液;紫色石蕊试液变红;
(5)二氧化碳的密度比空气大,且不能燃烧、不能支持燃烧,所以将①和④的导管口连接时,会看到烧杯中下面的蜡烛先熄灭,上面的蜡烛后熄灭;故填:密度比空气大,且不能燃烧、不能支持燃烧;
(6)装置E中放的是一个用空气充胀的气球,若气球出现F装置中浮起的情况,说明二氧化碳的密度比空气大;所以,设计该实验的目的是探究二氧化碳的密度是否比空气大;故填:CO2的密度比空气大.
点评 本题考查了学生对二氧化碳的制取和性质的掌握和应用,考查了学生依据所学知识分析和解决问题的能力.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案(1)若氧的相对原子质量为16,求一个氮原子的实际质量.
(2)若一个铝原子的实际质量为4.482×10-26kg,求铝原子的相对原子质量.
Ⅰ.探究二氧化碳与水的反应
| 方案一 | 方案二(数字化实验) |
 | 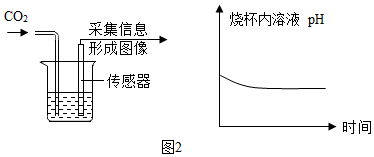 |
②由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变强(填“强”或“弱”).
Ⅱ.探究蜡烛燃烧的产物
| 方案一 | 方案二(数字化实验) |
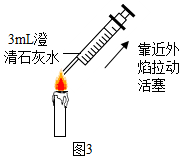 |  |
④如图4所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如坐标图所示,曲线b、c(选填“a”、“b”、“c”)能够说明蜡烛燃烧生成了二氧化碳和水.
Ⅱ.比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度
⑤写出碳酸钙与稀盐酸发生反应的化学方程式CaCO3+2HCl→CaCl2+H2O+CO2↑;
| 方案一 | 方案二(数字化实验) |
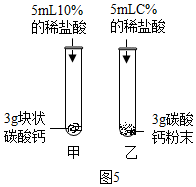 |  |
较之块状碳酸钙,碳酸钙粉末与稀盐酸的反应更为剧烈,原因是反应物之间的接触面积更大.
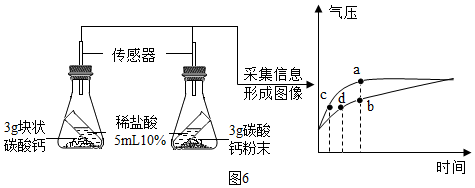
⑥按图6所示进行实验,倾斜锥形瓶使小试管内的稀盐酸流入瓶中与固体接触发生反应,瓶内气压的变化如坐标图所示.对比分析坐标图中的点c、d(选填a~d)可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短.
| A. | 尼古丁由三种元素组成 | |
| B. | 尼古丁是由10个碳原子、14个氢原子、2个氮原子构成 | |
| C. | 1个尼古丁分子含有26个原子 | |
| D. | 尼古丁中含有氮分子 |
| A. | 乙醇汽油是一种新型化合物 | |
| B. | 汽油是由石油制得 | |
| C. | 使用乙醇汽油可以减少SO2等有害气体的排放 | |
| D. | 用玉米等发酵可制得乙醇,乙醇是可再生资源 |
 为测定某含杂质铜的锌样品中锌的质量分数,取样品20克装入一容器,再取稀硫酸200克,平均分成4份并分4次加入容器中,测定生成气体的总质量,结果如下表:
为测定某含杂质铜的锌样品中锌的质量分数,取样品20克装入一容器,再取稀硫酸200克,平均分成4份并分4次加入容器中,测定生成气体的总质量,结果如下表:| 稀盐酸的质量 | 第一次50g | 第二次50g | 第三次50g | 第四次50g |
| 生成气体总质量 | 0.2g | m | 0.6g | 0.6g |
(2)20克样品与稀硫酸反应最多产生氢气是0.6g;
(3)计算样品中锌的质量分数是多少?(写出计算过程)
(4)画出生成气体质量与所加稀硫酸的关系曲线图.

 无土栽培大讲堂.无土栽培是指不用天然土壤而用基质,在定植以后用营养液进行灌溉的栽培方法.
无土栽培大讲堂.无土栽培是指不用天然土壤而用基质,在定植以后用营养液进行灌溉的栽培方法.