题目内容
1. 甲、乙、丙三种物质的溶解度曲线如图所示:
甲、乙、丙三种物质的溶解度曲线如图所示:①图中a点的含义是40℃时甲乙的溶解度相等;
②50℃时,35克乙物质的饱和溶液中.含乙物质10克
③温度范围在0℃~40℃时,乙的溶解度大于甲的溶解度
④甲中混有少量的氯化钠晶体,若要得到较纯净的甲应用降温结晶(或冷却热饱和溶液)方法
⑤下列说法中错误的是AD
A、5℃时,甲、乙、丙三种物质溶液的溶质质量分数一定不相等
B、40℃时.甲、乙的饱和溶液溶质的质量分数一定相等
C、甲、乙、丙三种物质的溶液分别升温(溶剂不蒸发),丙的浓度可能发生改变
D、50℃,甲、乙、丙三种物质的饱和溶液降温到20℃时,析出晶体最多的是甲.
分析 ①溶解度曲线的交点表示该温度下二者的溶解度相等;
②根据物质的溶解度曲线可以判断物质的溶解度,据其意义解答;
③据溶解度曲线可比较物质的溶解度大小;
④根据物质的溶解度曲线可以判断物质的溶解度受温度变化的影响,进而分析提纯物质的方法;
⑤据物质在不同温度下的溶解度和溶解度随温度变化情况分析解答.
解答 解:①图中a点表示在40℃时,甲乙两物质的溶解度相同;
②50℃时乙的溶解度是40g,即100g水中最多溶解40g的乙,形成饱和溶液140g,则35克乙物质的饱和溶液中含乙物质 的质量是:$\frac{40g}{140g}$×35g=10g;
③由图可知:温度范围在时0℃~40℃,乙的溶解度大于甲的溶解度;
④甲的溶解度受温度影响较大,氯化钠的溶解度受温度影响不大,所以若甲中混有少量的氯化钠晶体,若要得到较纯净的甲应用 降温结晶或冷却热饱和溶液的方法;
⑤
A、由图可知:5℃时甲的溶解度最小,若是100g的水中加入三种溶质的质量为小于等于甲的溶解度,则甲恰好饱和溶质全部溶解,乙、丙溶质全部溶解,形成不饱和溶液,溶质、溶剂质量相等,则三种物质溶液的溶质质量分数相等,故错误;
B、饱和时质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,则溶解度相等溶质的质量分数相等,所以40℃时.甲、乙的饱和溶液溶质的质量分数一定相等,正确;
C、甲、乙、丙三种物质的溶液分别升温(溶剂不蒸发),甲乙的溶解度增大,溶液中溶质、溶剂质量不变,溶质的质量分数不变,丙的溶解度减小,析出晶体,溶质质量分数减小,描述正确;
D、50℃,甲、乙、丙三种物质的饱和溶液降温到20℃时,不知三种溶液质量大小,故无法判断析出晶体质量多少,故错误;
故答案为:①40℃时甲乙的溶解度相等;
②10;
③0℃~40℃;
④降温结晶(或冷却热饱和溶液);
⑤AD.
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,要结合题意细心分析解答

| 实验操作 | 实验现象 | 化学方程式(或结论) |
| 向少量草木灰溶液中滴加酚酞溶液 | 溶液变红 | 草木灰溶液呈碱性. |
| 向少量草木灰溶液中滴加 | 有气泡产生 | K2CO3+2HCl═2KCl+H2O+CO2↑ |
| 向少量草木灰溶液中滴加澄清石灰水 | 产生白色沉淀 | K2CO3+Ca(OH)2═CaCO3↓+2KOH |
(2)小青通过化学课上知道碱性的肥料不能和铵态氮肥混合使用,会降低肥效,因此小青建议爸爸这盆花近期不能施用B
A. CO(NH2)2 B.NH4HCO3 C.KNO3 D.NaNO3.
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | K2CO3溶液 | KCl | 加入适量的稀盐酸 |
| B | Fe | Zn | 加入足量的FeSO4溶液,充分反应,过滤,烘干 |
| C | NaOH溶液 | Na2CO3 | 加入足量的BaCl2溶液,充分反应,过滤 |
| D | H2 | HCl | 将气体通过盛浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 单质 | B. | 原子 | C. | 元素 | D. | 分子 |
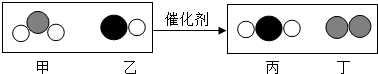
| A. | 乙物质由两个元素组成. | |
| B. | 甲和丁中同种元素化合价不相等 | |
| C. | 该反应中涉及到的最小微粒是分子 | |
| D. | 化学方程式中乙、丁的物质的量之比为1:1 |
| A. | 为了防止黄曲霉毒素对人体的危害,绝对不能食用霉变食物 | |
| B. | 为了保持身材苗条,只吃蔬菜和水果 | |
| C. | 为了防止摄入微量元素不足引起疾病,大量服用营养补剂 | |
| D. | 为了节约食材,用地沟油制成食用油 |
 如图是电解水的微观模型图,从中获得的信息不正确的是( )
如图是电解水的微观模型图,从中获得的信息不正确的是( )| A. | 在化学反应中,分子可以再分,原子不能再分 | |
| B. | 每个水分子由2个氢原子和1个氧原子构成 | |
| C. | 水分解过程中,原子的种类、分子的种类都不变 | |
| D. | 在化学反应中,元素的种类和质量都不改变 |
①蜡烛受热熔化 ②燃烧 ③灯泡发光 ④分离液态空气制氧气 ⑤火药爆炸.
| A. | ①②⑤ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ②⑤ |
 如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,不能观察到气球变大的一组物质是( )
如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,不能观察到气球变大的一组物质是( )| A. | 氯化钠和水 | B. | 浓硫酸和水 | ||
| C. | 生石灰和水 | D. | 二氧化锰和过氧化氢溶液 |