题目内容
8. 化学兴趣小组的同学发现试验台上一瓶标签残缺的无色溶液(如图所示),他们提出可能是Na2SO4、NaHCO3、Na2CO3溶液中的一种,于是决定对这瓶溶液进行实验探究.
化学兴趣小组的同学发现试验台上一瓶标签残缺的无色溶液(如图所示),他们提出可能是Na2SO4、NaHCO3、Na2CO3溶液中的一种,于是决定对这瓶溶液进行实验探究.查阅资料:三种物质溶液在常温下的pH如表
| 溶液 | Na2SO4 | NaHCO3 | Na2CO3 |
| pH | pH=7 | pH>7 | pH>7 |
(2)为确定其成分,小新同学设计如下方案进行探究
| 实验步骤 | 现象 | 结论 |
| ①取该溶液少许于试管中,滴加过量的BaCl2溶液,振荡. | 产生白色沉淀 | 该溶液是Na2CO3溶液 |
| ②继续滴加过量稀盐酸,振荡 | 白色沉淀全部溶解,产生气泡 |
实验现象:酚酞试液变红色;
实验结论:该溶液是碳酸钠溶液(写出实验步骤、现象及结论).
(4)为防止标签被腐蚀,倾倒液体时应注意标签向着手心.
分析 (1)该溶液不可能是NaHCO3,这是因为NaHCO3中,钠原子右下角是1,而标签残缺的无色溶液中,钠原子右下角是2;
(2)根据实验现象可以判断实验结论,根据实验结论可以判断实验现象;
(3)硫酸钠不能和稀盐酸反应,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
硫酸钠溶液显中性,不能使酚酞试液变色,碳酸钠溶液显碱性,能使酚酞试液变红色;
(4)为防止标签被腐蚀,倾倒液体时标签应该向着手心,以防液体下流时腐蚀标签.
解答 解:(1)该溶液不可能是NaHCO3,这是因为NaHCO3中,钠原子右下角是1,而标签残缺的无色溶液中,钠原子右下角是2.
故填:NaHCO3.
(2)①取该溶液少许于试管中,滴加过量的BaCl2溶液,振荡,产生白色沉淀;
②继续滴加过量稀盐酸,振荡,白色沉淀全部溶解,产生气泡,说明该溶液是Na2CO3溶液,实验过程如下表所示:
| 实验步骤 | 现象 | 结论 |
| ①取该溶液少许于试管中,滴加过量的BaCl2溶液,振荡. | 产生白色沉淀 | 该溶液是Na2CO3溶液 |
| ②继续滴加过量稀盐酸,振荡 | 白色沉淀全部溶解,产生气泡 |
实验方案是:实验步骤:取少量溶液于试管中,滴加酚酞试液;
实验现象:酚酞试液变红色;
实验结论:该溶液是碳酸钠溶液.
故填:①;实验步骤:取少量溶液于试管中,滴加酚酞试液;
实验现象:酚酞试液变红色;
实验结论:该溶液是碳酸钠溶液.
(4)为防止标签被腐蚀,倾倒液体时应注意标签向着手心,以防液体下流时腐蚀标签.
故填:标签向着手心.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
20.在化学实验的药品中,有些药品中含有少量杂质,为了除去药品中的杂质,下列所选的试剂及操作都正确的是( )
| 选项 | 药品 | 杂质 | 试剂 | 操作 |
| A | NaCl溶液 | Na2CO3 | 过量BaCl2溶液 | 结晶 |
| B | CO2 | CO | 过量氢氧化钠溶液 | 干燥 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉 | 过滤 |
| D | CaO固体 | CaCO3 | 足量的水 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
16.下列各项比较中,正确的是( )
| A. | 电子数:Fe2+>Fe3+ | B. | 含铁量:Fe2O3>FeO | ||
| C. | 地壳中元素含量:Fe>Al | D. | 水中溶解能力:O2>CO2 |
3.下列有关催化剂的说法中正确的是( )
| A. | 催化剂就是二氧化锰 | |
| B. | 催化剂能降低物质的化学反应速度 | |
| C. | 在化学反应前后催化剂的状态没有改变 | |
| D. | 催化剂可以使反应物进行反应且反应前后化学性质没有改变 |
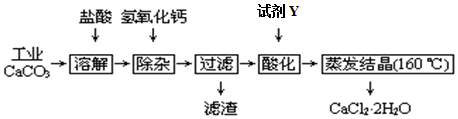
13.医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:
已知:查阅资料得知氢氧化物沉淀时的pH为:
(1)CaCO3与盐酸反应的离子方程式CaCO3+2H+=Ca 2++H2O+CO2↑
(2)除杂操作是加入氢氧化钙,调节溶液的pH范围应为2.3≤pH≤7.8(提示:找出PH范围的两个边界值,并选择适当的数学符号“<、>、≤、≥”,组成形如“边界值1<PH<边界值2”等等的不等式来表示PH范围),其目的是让铁离子和氯离子完全沉淀.
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和漏斗
(4)酸化的目的是:除去过量的氢氧化钙.所加试剂Y 名称为盐酸
(5)蒸发结晶要保持在160℃,为什么温度不能太高:由于要制备的是水合物,温度太高会导致水合物分解脱水.
(6)若所测样品 CaCl2•2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一是过程中除去了铁离子和氯离子,而钠离子没有去除,导致得到的水合物含有钠的化合物.

已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(2)除杂操作是加入氢氧化钙,调节溶液的pH范围应为2.3≤pH≤7.8(提示:找出PH范围的两个边界值,并选择适当的数学符号“<、>、≤、≥”,组成形如“边界值1<PH<边界值2”等等的不等式来表示PH范围),其目的是让铁离子和氯离子完全沉淀.
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和漏斗
(4)酸化的目的是:除去过量的氢氧化钙.所加试剂Y 名称为盐酸
(5)蒸发结晶要保持在160℃,为什么温度不能太高:由于要制备的是水合物,温度太高会导致水合物分解脱水.
(6)若所测样品 CaCl2•2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一是过程中除去了铁离子和氯离子,而钠离子没有去除,导致得到的水合物含有钠的化合物.
20.下列物质的用途中,利用其物理性质的是( )
| A. | 氧气用于急救病人 | B. | 铁粉用作脱氧剂 | ||
| C. | 干冰用作制冷剂 | D. | 熟石灰用于改良酸性土壤 |
17.下列实验基本操作错误的是( )
| A. |  检查装置气密性 | B. |  点燃酒精灯 | C. |  滴加液体 | D. |  加热液体 |
18.下列各组离子可在pH=1的溶液中大量共存的是( )
| A. | SO42-、Na+、CO32- | B. | Fe3+、SO42-、Cl- | C. | Mg2+、Cl-、OH- | D. | Na+、Ba2+、SO42- |
