题目内容
6.将8.3g由Al,Zn两种金属组成的混合物加入到一定量的稀硫酸中,恰好完全反应,将反应后的溶液蒸干,得到无水固体27.5g,则反应中产生的氢气的质量为0.4g.分析 铝与稀硫酸反应生成硫酸铝和氢气,锌与稀硫酸反应生成硫酸锌和氢气;将8.3g由铝和锌组成的混合物加入到稀硫酸中,恰好完全反应.将反应后的溶液蒸干,得到无水固体27.5g,无水固体为生成的硫酸铝和硫酸锌的混合物,可计算出无水固体中硫酸根离子的质量,进而确定氢气的质量,进行分析解答即可.
解答 解:反应后得到的无水固体为生成的硫酸铝和硫酸锌的混合物,则固体增加的质量即为硫酸根离子的质量,其质量为27.5g-8.3g=19.2g;由质量守恒定律,反应前后硫酸根离子的质量不变,则设氢元素中溶质的质量为x
则在盐酸中氢与硫酸根的关系:
2H~SO4
2 96
x 19.2g
$\frac{2}{x}=\frac{96}{19.2g}$
x=0.4g,
由质量守恒定律,反应前后元素不变,所以反应中产生的氢气的质量0.4g.
答案:0.4g.
点评 本题难度较大,重点在于掌握利用化学方程式的计算、质量守恒定律是正确解答本题的关键所在

练习册系列答案
相关题目
17.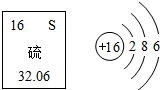 如图是元素周期表中的硫元素及其原子结构示意图,下列说法正确的是( )
如图是元素周期表中的硫元素及其原子结构示意图,下列说法正确的是( )
 如图是元素周期表中的硫元素及其原子结构示意图,下列说法正确的是( )
如图是元素周期表中的硫元素及其原子结构示意图,下列说法正确的是( )| A. | 硫元素属于金属元素 | B. | 硫原子在化学反应中容易失去电子 | ||
| C. | 硫的相对原子质量为32.06g | D. | 硫离子最外层上有8个电子 |
14.下列化学式书写规范的是( )
| A. | 氧化镁mgO | B. | 硫酸铜cuSO4 | C. | 五氧化二氮N2O5 | D. | 氦气HE |
11.以下化肥中不属于钾肥的是( )
| A. | KCl | B. | K2SO4 | C. | NH4NO3 | D. | K2CO3 |
15.下列离子在pH=1的溶液中能够大量共存的是( )
| A. | SO42-、Na+、K+、Cl- | B. | Ca2+、K+、Cl-、CO32- | ||
| C. | Fe2+、CO32-、K+、Cl- | D. | Al3+、Ag+、K+、Cl- |
16.一些食物的近似值pH如下,下列说法不正确的是( )
| 食物 | 苹果汁 | 葡萄汁 | 牛奶 | 鸡蛋清 |
| pH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 7.6~8.0 |
| A. | 葡萄汁比苹果汁的酸性强 | B. | 苹果汁和葡萄汁都能石蕊试液变红 | ||
| C. | 牛奶和鸡蛋清都接近中性 | D. | 胃酸过多的人应少饮苹果汁 |