题目内容
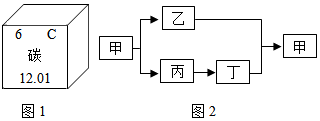
1.碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.(1)如图1是元素周期表中的一格,碳的原子结构示意图为
 .
.(2)写出由碳元素组成的两种单质金刚石、石墨、C60等其中两种,碳的单质都是由碳元素组成,但它们的性质却存在明显差异,其原因是碳原子排列方式不同.
(3)“低碳生活”倡导低能量、低消耗,主要是为了减少CO2(填化学式)的排放量.
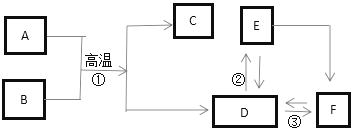
(4)甲、乙、丙、丁是初中化学常见的化合物,甲和乙中含有碳元素,丙能做干燥剂.它们之间有如图2所示的转化关系(部分物质和反应条件已略去).则甲的化学式为CaCO3;甲生成乙和丙的化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,乙和丁反应生成甲的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O.
(5)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量 为58.1g(不包括烧杯的质量,且气体的溶解忽略不计).试计算石灰石中杂质的质量分数.
分析 (1)碳是质子数为6的元素,其原子的核外电子排布为2,4.
(2)碳原子通过不同的排列方式形成了金刚石、石墨和足球烯等单质.
(3)“低碳生活”倡导低能量、低消耗,主要是为了减少CO2 的排放量.
(4)丙能做干燥剂,初中做干燥剂的一般为生石灰、浓硫酸,且丙为含碳化合物所得,所以应该为生石灰,甲为碳酸钙,乙为二氧化碳,其余再推断即可.
(5)根据质量守恒定律,可知质量差量就是生成的二氧化碳,根据二氧化碳的质量和化学方程式求算碳酸钙的质量,进而求算样品中杂质的质量分数.
解答 解:
(1)碳元素为质子数为6的元素,其原子的电子排布为2,4.故碳的原子结构示意图为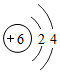 .
.
(2)由碳元素组成的两种单质金刚石、石墨、C60等(其中两种,不主张写C70或者C80等课外练习遇到的新物质),碳的单质都是由碳元素组成,但它们的性质却存在明显差异,其原因是碳原子排列方式不同.
(3)“低碳生活”倡导低能量、低消耗,主要是为了减少 CO2(填化学式,注意要求是化学式,写名称不得分)的排放量.
(4)丙能做干燥剂,初中做干燥剂的一般为生石灰、浓硫酸,且丙为含碳化合物所得,所以应该为生石灰,甲为碳酸钙,乙为二氧化碳.而二氧化碳和生石灰得到的产物进一步反应得到碳酸钙,所以丁为氢氧化钙.则甲的化学式为CaCO3;甲生成乙和丙就是碳酸钙分解为二氧化碳和氧化钙,其对应化学方程式为 CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,乙和丁反应生成甲,是二氧化碳和氢氧化钙反应,生成碳酸钙和水,对应的化学方程式为 Ca(OH)2+CO2$\frac{\underline{\;高温\;}}{\;}$CaCO3↓+H2O.
(5)根据质量守恒定律可知,生成的二氧化碳的质量为12.5g+50g-58.1g=4.4g.
设12.5 g 石灰石样品中含CaCO3的质量为x
CaCO 3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10 g
杂质的质量分数=$\frac{12.5g-10g}{12.5g}$×100%=20%
故答案为:
(1)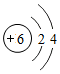 (2)金刚石、石墨、C60 等其中两种(有错不给分);碳原子排列方式不同;(3)CO2;(4)CaCO3;
(2)金刚石、石墨、C60 等其中两种(有错不给分);碳原子排列方式不同;(3)CO2;(4)CaCO3;
CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑;Ca(OH)2+CO2═CaCO 3↓+H2O;
(5)解:根据质量守恒定律可知,生成的二氧化碳的质量为12.5g+50g-58.1g=4.4g.
设12.5 g 石灰石样品中含CaCO3的质量为x
CaCO 3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10 g
杂质的质量分数=$\frac{12.5g-10g}{12.5g}$×100%=20%
点评 根据质量守恒定律可以推测生成的气体的质量,根据方程式计算对应物质.解题时要注意题目的要求,不要答非所问.

| A. | 生活污水及工业废水、废气直接向大气排放 | |
| B. | 大量使用煤、石油、天然气等化石燃料 | |
| C. | 大量砍伐森林,以满足建设需要;大量捕杀濒危野生动物,以满足饮食需要 | |
| D. | 把生产和消费过程中产生的废弃物进行收集和处置,回收可利用资源 |
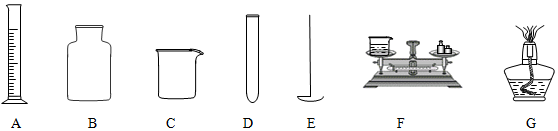
(1)写出仪器E的名称燃烧勺
(2)以上前四种玻璃仪器,可以在酒精灯上直接加热是DE(填序号)
(3)量取一定体积的液体选用的仪器是A; 读数时视线要与液体凹液面的最低处持水平.
(4)用仪器E在B中做硫在氧气中燃烧的实验时,预先在B中放少量水的目的是:吸收二氧化硫,防止污染空气
(5)实验中用D取用药品,如果没有说明用量,就应该取最少量:液体1-2ml;固体盖满试管底部即可.
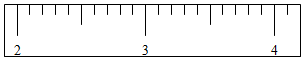
(6)如图:用F称量某烧杯的质量,称量结果是该烧杯质量为37.7g.请你把添加砝码和移动游码的过程表示出来:“↓”表示添加砝码,“↑”表示取走砝码;用签字笔在上刻度尺上用“|”表示出游码移动到的位置.
| 砝码大小/g | 100 | 50 | 20 | 20 | 10 | 5 |
| 取用情况 | ↓↑ |
(7)验证酒精灯G燃烧后生成水的实验操作是先将酒精灯点燃,在火焰上方罩一个干冷的烧杯,烧杯内壁出现水雾,证明酒精燃烧后有水生成.
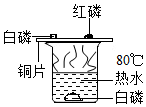 化学课上我们曾经观察过如图所示的实验:
化学课上我们曾经观察过如图所示的实验:
 如图是实验室所用盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
如图是实验室所用盐酸试剂瓶上标签的部分内容.请仔细阅读后计算: