题目内容
8. 如图是木炭还原氧化铜的探究实验装置.
如图是木炭还原氧化铜的探究实验装置.【提出问题】木炭还原氧化铜产生什么气体?
【提出猜想】产生的气体有三种情况:①CO ②CO2 ③CO和CO2.
【设计方案】实验前后分别对试管和烧杯里的物质进行称量,数据设计如下:
| 称量对象 | 反应前质量 | 反应后质量 | 质量差 |
| 试管+固体混合物 | M1 | M2 | △m1即( M1-M2) |
| 烧杯+澄清石灰水 | M3 | M4 | △m2即( M4-M3) |
(2)若猜想②正确,理论上△m1与△m2 的关系是:△m1=△m2(填“>”、“<”或“=”)
【实验并记录】实验得到的数据如下表:
| 称量对象 | 反应前质量 | 反应后质量 | 质量差 |
| 试管+固体混合物 | 69.8g | 65.4g | △m1 |
| 烧杯+澄清石灰水 | 118.8g | 122.6g | △m2 |
【反思与评价】经查阅资料知道:木炭还原氧化铜时是产生CO2气体,即反应的化学方程式为:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
(1)本次实验结果与资料结果不一致.对其可能原因有同学提出下列分析:
A.装置漏气 B.生成的CO2部分与过量的C反应生成了CO
C.澄清石灰水吸收CO2效果不好 D.装置内还有CO2气体未被吸收
你认为上述分析中合理的是ABCD.
(2)针对分析C,为了提高CO2的吸收效果,可以改进实验,改进的方法是用氢氧化钠溶液代替澄清石灰水.
分析 【提出猜想】木炭还原氧化铜产生什么气体应可能有:①CO;②CO2;③CO和CO2三种情况;
【设计方案】(1)从CO不溶于水,CO2溶于水考虑;
(2)从CO不溶于水,CO2溶于水考虑;
【实验并记录】根据表中提供的数据和【设计方案】中的结论分析;
【反思与评价】根据反应物、反应条件和生成物写出化学反应式;
(1)根据实验中可能发生的现象分析实验结果与资料显示不一致的原因;
(2)要代替澄清石灰水的应是吸收二氧化碳的能力比石灰水强的物质.
解答 解:【提出猜想】木炭还原氧化铜产生什么气体应可能有:①CO;②CO2;③CO和CO2三种情况;
故答案为:CO和CO2;
【设计方案】(1)因CO不溶于水,CO2溶于水,△m2=0,说明反应产生的气体不能被澄清石灰水吸收,是CO,所以猜想①成立;
故答案为:①;
(2)因CO不溶于水,CO2溶于水,若猜想②正确,理论上△m1与△m2 的关系是:△m1=△m2
故答案为:=
【实验并记录】根据表中的数据可知:△m1=69.8-65.4=4.4g△m2=122.6-118.8=3.8g△m2≠0△m1≠△m2 所以猜想①②都不成立,应该是猜想③成立.
故答案为:③;
【反思与评价】反应物是碳和氧化铜,反应条件是高温,生成物是铜和二氧化碳,化学反应式是:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
故答案为:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
(1)本次实验结果与资料显示不一致.对其可能原因有同学提出下列分析,其中合理的是:
A、若装置漏气,对△m1没有影响,但生成的CO2部分漏出,造成△m2偏低,故A选;
B、若生成的CO2部分与过量的C反应生成了CO,会造成CO2偏低,△m2偏低,故B选;
C、若澄清石灰水吸收CO2效果不好,会造成△m2偏低,故C选;
D、若装置内还有CO2气体未被吸收,会造成△m2偏低,故D选.
故答案为:ABCD;
(2)氢氧化钠溶液吸收CO2的效果比石灰水好的多,所以可以用氢氧化钠溶液代替石灰水.
故答案为:氢氧化钠.
点评 本题以实验探究的形式考查一氧化碳和二氧化碳的性质,同学们只有充分了解了它们的性质并能灵活运用才可做好此题.从此题也可以了解到基础知识的重要性,我们要学好基础,以不变应万变.

| A. | 减少食物加工过程 | B. | 注意节约用电 | ||
| C. | 尽量购买本地的、当季的食物 | D. | 大量使用化肥和农药 |
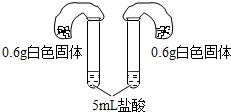 碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.
碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.【查阅资料】
(1)碳酸钠和碳酸氢钠在不同温度下的溶解度
| 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.lg | 12.7g |
| 性质 | Na2CO3 | NaHCO3 | 性质比较 |
| 溶液的酸碱性 | 碱性 | 碱性 | 相同条件下,Na2C03溶液的碱性更强 |
| 热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2C03、C02 和H20 |
| 与盐酸反应 | 反应 | 反应 | 均产生CO2,但NaHCO3与盐酸的反应更加剧烈 |
| 实验方案 | 实验现象及结论 1 |
| 方案一:20℃时,在100g水中加入11g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种白色固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,将其与标准比色板对照. | pH值小的为碳酸氢钠溶液. |
| 方案三:分却取少量固体于試管中加热,然后将产生的气体通入石灰水中. | 能产生使石灰水变浑浊的气体的是碳酸氢钠. |
| 方案四:如图所示,分别将气球中的固体粉末全部且同时倒入装有过量盐酸的试管中,观察现象. | 1.试管中剧烈反应,反应更加剧烈的是碳酸氢钠; 2.反应后两气球鼓起,鼓起较大的是碳酸氢钠. |
(1)通过上述实验,我们知道依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
(2)在两种物质中,我们一般选用碳酸氢钠来治疗胃酸过多.理由是碳酸氢钠比碳酸钠碱性弱,比较安全.
(3)方案二中,为何都配制成质量分数相同的溶液?溶液浓度的不同,会导致溶液pH值的不同
(4)请写出方案四中任意反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑.
现有下列三组物质:
A.空气、硫酸铜、冰水、蔗糖
B.KOH、H2SO4、Ca(OH)2、Ba(OH)2
C.NH4Cl、Na2CO3、SO2、Na2SO4
(1)填写下表空白
| 组别 | A组 | B组 | C组 |
| 分类标准 | 纯净物 | 碱 | 盐 |
| 不属于上述分类标准的物质 | 空气 | H2SO4 | SO2 |
(3)用上述的物质写一个化学反应方程式(生成物中有二种沉淀)CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓.
| A. | 39×27×(32+16×4)×2+12×18 | B. | 39+27+(32+16×4)×2+12×2×1+18 | ||
| C. | 39+27+(32+16×4)×2×12×(1×2+16) | D. | 39+27+(32+16×4)×2+12×(1×2+16) |
 “石头纸”也叫石科纸.2010年两会期间,政协委员们领到的会议通知、日程表、便签纸等都是以碳酸钙为主要原料(假设其它物质不溶于水也不参加反应)的低碳“石头纸”.我校化学兴趣小组的同学对这种“石头纸”产生了浓厚的兴趣,进行了如下实验:
“石头纸”也叫石科纸.2010年两会期间,政协委员们领到的会议通知、日程表、便签纸等都是以碳酸钙为主要原料(假设其它物质不溶于水也不参加反应)的低碳“石头纸”.我校化学兴趣小组的同学对这种“石头纸”产生了浓厚的兴趣,进行了如下实验: 如图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应.请回答:
如图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应.请回答: