题目内容
2.将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体.某研究性学习小组对蓝色固体的成分进行了如下探究.请完成下列各题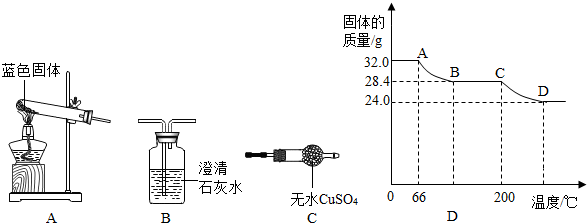
(一)猜想与假设:
猜想一:固体为CuCO3,理由:Na2CO3+CuSO4=CuCO3↓+Na2SO4(用化学反应方程式表示).
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈酸(填“酸”或“碱”)性.
猜想三:固体为Cu(OH)2和CuCO3的混合物.
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水; ②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物.
(三)设计与实验:
Ⅰ.固体的获取:(1)将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体.
(2)判断固体已洗净的方法及现象取最后洗涤液少量,滴加适量的稀盐酸(硝酸、硫酸),无气泡产生.蓝色固体澄清石灰水无水CuSO4
Ⅱ.用如图所示装置,定性探究固体的成分.
(3)若用装置A、B组合进行实验,B中无现象,则猜想二正确;
(4)若用装置A、C组合进行实验,C中无现象,则猜想一正确;
(5)小组同学将装置按 A、C、B(填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的,实验中:B中的现象为澄清的石灰水变浑浊,C中的现象为白色固体变蓝.
结论:固体为Cu(OH)2和CuCO3的混合物.
Ⅲ.固体成分定量测定:已知Cu(OH)2的分解温度为66℃∽68℃,CuCO3的分解温度为200℃∽220℃.设固体的组成为aCu(OH)2•bCuCO3.小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图D,请根据图示回答下列问题:
(6)写出A B、C D段发生反应的化学方程式:
AB段:Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
CD段:CuCO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+CO2↑;
(7)通过计算可得:a:b=2:1.
(8)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后固体的质量/g温度/℃质量不再改变,写出此过程中可能发生反应的化学方程式:4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑.
分析 【猜想与假设】猜想一:根据碳酸钠和硫酸铜反应生成蓝色沉淀进行分析,
猜想二:根据氢氧根离子会与铜离子生成氢氧化铜沉淀进行分析,
【设计与实验】(1)分离固液混合物的方法是过滤.
(2)判断固体洗净的标准是看还有没有碳酸钠.
(3)(4)(5)Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物.则氢氧化铜受热分解生成水和氧化铜,碳酸铜受热分解生成二氧化碳和氧化铜,根据它们受热分解的生成物来判断哪种猜想正确.
(6)Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,可知AB段为氢氧化铜在分解,CD段为碳酸铜在分解.
(7)氢氧化铜受热过程中固体减少的质量是水的质量,根据水的质量可求出氢氧化铜的质量,碳酸铜在受热过程中减少的是二氧化碳的质量,根据二氧化碳的质量可求出碳酸铜的质量.
(8)剩余固体加热到更高温度固体的质量又会减少,根据氧化铜中所含的两种元素可猜想可能是氧化铜中的氧元素转化为氧气,根据计算会发现氧化铜中氧元素的质量大于固体减少的质量,那么就可能是氧化铜中的部分氧元素转化为氧气.
解答 解:猜想一:碳酸钠和硫酸铜反应生成碳酸铜沉淀和硫酸钠,故答案为:Na2CO3+CuSO4=CuCO3↓+Na2SO4
猜想二:碳酸钠是强碱弱酸盐,在水中会进行水解生成氢氧根离子,显碱性,故答案为:碱
Ⅰ.(1)分离固液混合物的方法是过滤.故答案为:过滤
(2)固体洗净,固体中将没有碳酸钠,最后洗涤液中也没有碳酸钠,只需要证明最后洗涤液中没有碳酸根离子就行了.故答案为:取最后洗涤液少量,滴加适量的稀盐酸(硝酸、硫酸),无气泡产生;或滴加BaCl2[或Ba(OH)2、Ba(NO3)2]或CaCl2[或Ca(OH)2、Ca(NO3)2]溶液,无沉淀产生.
Ⅱ.(3)Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物.则氢氧化铜受热分解生成氧化铜和水,碳酸铜受热分解生成氧化铜和二氧化碳.石灰水不变浑浊,说明没有二氧化碳生成,固体中就没有碳酸铜,只有氢氧化铜.故答案为:二
(4)无水硫酸铜不变蓝说明没有水生成,固体中就没有氢氧化铜,只有碳酸铜.故答案为:一
(5)要证明生成物中有水和二氧化碳,应先证明水再证明二氧化碳,若先证明二氧化碳的话,即使原气体中没有水蒸汽,气体通过石灰水后也会从石灰水中带出水蒸汽.
故选C;B; 澄清的石灰水变浑浊; 白色固体变蓝
(6)AB段的温度大于60℃但是没有超过200℃,从图象中看出也不超过100℃,符合氢氧化铁的分解温度,故答案为:Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
CD段的温度超过了200℃,符合碳酸铜的分解温度,故答案为:CuCO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+CO2↑
(7)AB段减少的是水的质量,根据水的质量可求出氢氧化铜的质量.
设氢氧化铜的质量为x
Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O
98 18
x 32g-28.4g
$\frac{98}{x}$=$\frac{18}{32g-28.4g}$
x=19.6g
CD段减少的是二氧化碳的质量,根据二氧化碳的质量可求出碳酸铜的质量.
设碳酸铜的质量为y
CuCO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+CO2↑
124 44
y 28.4g-24g
$\frac{124}{y}$=$\frac{44}{28.4g-24g}$
y=12.4g
x:y=19.6g:12.4g=49:31
氢氧化铜的相对分子质量为98,碳酸铜的相对分子质量为124.
a:b=$\frac{49}{98}$:$\frac{31}{124}$=2:1
故答案为:2:1
(8)氧化铜加热后质量又会减少,应该是氧化铜中的氧元素转化为氧气,24g氧化铜的氧元素的质量=24g×$\frac{16}{80}$=4.8g,大于2.4g,说明是氧化铜中的部分氧元素转化为氧气.
故答案为:4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑.
点评 检验混合物中的水蒸汽和二氧化碳时,应先检验水蒸汽,再检验二氧化碳,因为若先检验二氧化碳的话,即使原混合物中没有水蒸汽也会从石灰水中带出水蒸汽.除去混合物中的水蒸汽和二氧化碳时,应先除二氧化碳,再除水蒸汽,因为若先除水蒸汽的话,通过石灰水或氢氧化钠溶液除二氧化碳时又会让气体中混入水蒸汽.

 备战中考寒假系列答案
备战中考寒假系列答案【提出问题】滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH 猜想二:NaOH和Ca(OH)2.
猜想三:NaOH和Na2CO3 猜想四:NaOH、Na2CO3和Ca(OH)2
经过讨论,大家一致认为猜想四不合理,其原因是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【实验验证】
| 实验 | 现象 | 结论 |
| 实验一:取滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
| 实验二:另取滤液,向其中加入足量稀盐酸 | 先无变化后产生气泡 | 猜想三成立 |
【反思与拓展】登山运动员常用CaH2作为能源提供剂,与氢气相比的优点是携带安全.
| A. | 氮气可用于食品保鲜 | B. | 氧气可用于焊接金属 | ||
| C. | 氢氧化钠可用于干燥二氧化硫气体 | D. | 水晶的主要成分SiO2属于氧化物 |
| ×××钙片 [药品规格]每片含CaCO3 0.625g,维生素D100国际单位. [用法用量]每次1片,每天2次 |
(2)CaCO3中钙元素的质量分数为多大?
(3)若每片此钙片的质量为1g,按用量服用,每天摄入钙元素的质量为多少克?
| 化学符号 | 2N | 2CO |  | 2Na+ |
| 表示意义 | 2个氮原子 | 2个一氧化碳分子 | 钾原子核内有19个质子 | 2个钠离子 |
 “2014青岛世园会”于4月25日正式开园,主题是“让生活走进自然”,倡导人与自然和谐相处的绿色发展理念.
“2014青岛世园会”于4月25日正式开园,主题是“让生活走进自然”,倡导人与自然和谐相处的绿色发展理念.