题目内容
10.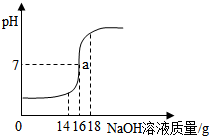 小丽在实验室进行酸碱中和实验,她将未知浓度的NaOH溶液逐滴加入到质量为20g浓度为14.6%的稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示.请回答:
小丽在实验室进行酸碱中和实验,她将未知浓度的NaOH溶液逐滴加入到质量为20g浓度为14.6%的稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示.请回答:(1)当NaOH溶液质量加到18g,溶液的溶质为NaCl NaOH;
(2)该未知浓度的氢氧化钠溶液的溶质质量分数.
分析 (1)根据当恰好完全反应时,消耗NaOH溶液的质量为16g,当NaOH溶液质量加到18g,溶液的pH>7,氢氧化钠溶液过量进行分析解答;
(2)根据质量为20g浓度为14.6%的稀盐酸中氯化氢的质量,进一步可以计算NaOH溶液中溶质的质量.
解答 解:(1)当恰好完全反应时,消耗NaOH溶液的质量为16g,当NaOH溶液质量加到18g,溶液的pH>7,氢氧化钠溶液过量,溶液的溶质为氯化钠和氢氧化钠;
(2)当恰好完全反应时,消耗NaOH溶液的质量为16g.
设NaOH溶液中的溶质质量为x,20g浓度为14.6%的稀盐酸中氯化氢的质量=20g×14.6%=2.92g
NaOH+HCl═NaCl+H2O,
40 36.5
x 2.92g
$\frac{40}{x}=\frac{36.5}{2.92g}$
x=3.2g
该未知浓度的氢氧化钠溶液的溶质质量分数=$\frac{3.2g}{16g}×$100%=20%
答案:
(1)NaCl NaOH;
(2)该未知浓度的氢氧化钠溶液的溶质质量分数为20%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
1. 如图为空气成分示意图(按体积计算),其中“a”代表的是( )
如图为空气成分示意图(按体积计算),其中“a”代表的是( )
 如图为空气成分示意图(按体积计算),其中“a”代表的是( )
如图为空气成分示意图(按体积计算),其中“a”代表的是( )| A. | 氧气 | B. | 氮气 | C. | 其他成分 | D. | 稀有气体 |
18.如图基本操作正确的是( )
| A. |  称取食盐 | B. |  CO2验满 | C. |  测溶液PH | D. |  取用块状固体 |
5.践行绿色生活,创造可持续消费和生产的条件是“世界环境日”的永恒主题,下列生产或生活中的做法,符合这一主题的是( )
| A. | 提倡节日大量燃放烟花爆竹,增加喜庆气氛 | |
| B. | 为解决“白色污染”问题,应将废旧塑料袋焚烧处理 | |
| C. | 为提高农作物产量并减少污染,应合理使用农药和化肥 | |
| D. | 为了使食品保质期延长,我们在食品中加入大量防腐剂 |
15.下列说法错误的是( )
| A. | 可用聚乙烯包装食品 | B. | 补锌可用来防治侏儒症 | ||
| C. | 在食用猪血中添加甲醛溶液 | D. | 在蒸馒头时添加纯碱 |
2.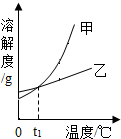 NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
 NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )| 温度/℃ | 20 | 30 | 50 | 60 | |
| 溶解度S/g | NH4Cl | 37.2 | 41.4 | 50.4 | 55.2 |
| KNO3 | 31.6 | 45.3 | 85.5 | 110 | |
| A. | 甲表示NH4Cl溶解度曲线 | |
| B. | t1应介于20℃~30℃ | |
| C. | 40℃时,给饱和溶液蒸发相同质量的水,析出晶体的质量:KNO3>NH4Cl | |
| D. | 50℃时,在50g水中分别加入30gKNO3、30gNH4Cl,得到的溶液质量分数都是37.3% |
19.如图为某反应的微观示意图,其中不同的球代表不同元索的原子.下列说法正确的是( )


| A. | 反应前后质量减少 | B. | 丙的化学式为C02 | ||
| C. | 该反应为置换反应 | D. | 甲物质用于灭火 |
20.水在化学实验中用途广泛,都科书下列实验图示中的水没有发生化学变化的是( )
| A. |  硫的燃烧 | B. |  探究燃烧条件 | ||
| C. |  电解水实验 | D. |  花喷水后放入CO2中 |
