题目内容
18.有X,Y,Z3种元素,它们的核内质子数均不超过18.它们相互之间能形成X2Z和YZ2型化合物.已知X+和Y原子的电子层数相同,Y原子比Z原子少2个电子,Z原子的最外层电子数是次外层电子数的3倍.这3种微粒结构示意图是X+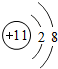 ,Y原子
,Y原子 ,Z元素的离子
,Z元素的离子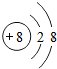 .若将0.62克X2Z放入18.2克水中得A溶液,则溶液中溶质的质量分数为4.3%,pH值>7(填“>”,“<”,“=”).
.若将0.62克X2Z放入18.2克水中得A溶液,则溶液中溶质的质量分数为4.3%,pH值>7(填“>”,“<”,“=”).
分析 (1)核外电子在分层排布时,应遵循各电子层最多容纳电子数2n2;由题意知:“Z原子的最外层电子数是次外层电子数的3倍”,则推测Z为氧元素,根据“X+和Y原子的电子层数相同,Y原子比Z原子少2个电子”
,则推测Y元素为碳元素,而X为钠元素,则推测X2Z和YZ2型化合物分别为Na2O,CO2.这3种微粒结构示意图是X+ ,Y原子
,Y原子 ,Z元素的离子
,Z元素的离子 .
.
(2)氧化钠遇水发生化合反应生成氢氧化钠,因此将0.62克X2Z放入18.2克的水中,所得溶液为氢氧化钠溶液;则所得溶液中溶质的质量分数=$\frac{氢氧化钠的质量}{溶液的质量}$×100%;氢氧化钠溶液是碱.
解答 解:(1)(1)核外电子在分层排布时,应遵循各电子层最多容纳电子数2n2;由题意知:“Z原子的最外层电子数是次外层电子数的3倍”,则推测Z为氧元素,根据“X+和Y原子的电子层数相同,Y原子比Z原子少2个电子”,则推测Y元素为碳元素,而X为钠元素,则推测X2Z和YZ2型化合物分别为Na2O,CO2.故
(2)氧化钠遇水发生化合反应生成氢氧化钠,因此将0.62克X2Z放入18.2克的水中,所得溶液为氢氧化钠溶液;则设生成氢氧化钠的质量为x.
Na2O+H2O=2NaOH
62 80
0.62g x
则$\frac{62}{80}=\frac{0.62g}{x}$,解得x=0.8g.$\frac{0.8g}{0.62g+18.2g}$
所得溶液中溶质的质量分数=$\frac{0.8g}{0.62g+18.2g}$×100%≈4.3%
因为氢氧化钠溶液是碱,故pH值>7.
故答案为:
 ,
, ,
, . 4.3%,>.
. 4.3%,>.
点评 此题是对核外电子排布的考查题,解题的关键是利用题干所提供的信息,结合课本上所学的知识解决,考查了学生对信息的实际应用能力.

| A. | 都是银白色的金属 | B. | 都能与稀硫酸反应 | ||
| C. | 都能被磁铁吸引 | D. | 都能与氧气反应 |
| A. | 电解水 | B. | 干冰气化 | C. | 铁生锈 | D. | 白磷自燃 |


