题目内容
6.硫酸亚铁是一种重要的食品和饲料添加剂,为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4•xH2O)中铁元素的含量,某化学兴趣小组设计以下实验方案:[探究一]利用废水回收铜,制备硫酸亚铁晶体:
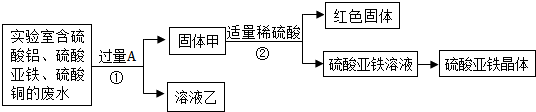
(1)加入固体A是Fe,固体甲中含有的物质是Fe和Cu;溶液乙中溶质是Al2(SO4)3、FeSO4.
(2)写出步骤①的化学方程式:Fe+CuSO4═FeSO4+Cu,检验步骤①向废液中加入A是否过量的物理方法是继续向废液中加入稀硫酸,看是否有气泡产生.
[探究二]将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
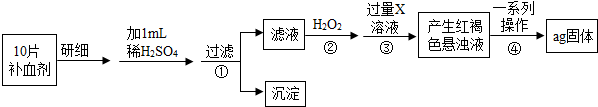
(3)步骤②中H2O2得到了Fe2(SO4)3,加入过量的X发生的反应③方程式Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4 .
(4)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量得到ag固体,样品补血剂中铁元素的质量为0.07ag(用含a的代数式表示).
[探究三]某硫酸亚铁晶体(FeSO4•xH2O)热分解研究
(5)该兴趣小组同学称取27.8g硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值.
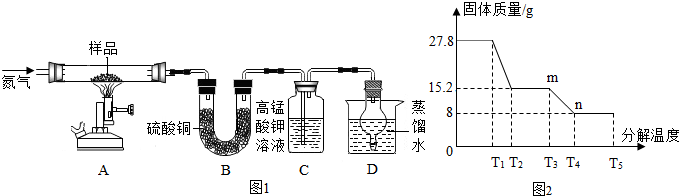
装置B中硫酸铜粉末变蓝,质量增加12.6g,x的值7;实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”);装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.装置D 的作用是吸收二氧化硫防止污染空气.
(6)杨龙宇同学收集到硫酸亚铁完全分解后的固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,于是他得出结论硫酸亚铁分解得到产物“只有两种”,你认为杨龙宇得出的结论是错误(错误或正确)的,请写出m→n的化学方程式:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
分析 【探究一】从含有硫酸铝、硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁,加入的过量的金属A应是铁,根据铁与硫酸铜的反应写出①的反应的方程式,分析固体甲的成分及溶液乙中的溶质;
【探究二】由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
【探究三】
(5)有无水硫酸铜粉末变蓝,说明产物中有水,水的质量为12.6g,根据水和氧化铁的质量求x的值;根据实验中要持续通入氮气的作用,分析x的变化;二氧化硫能使高锰酸钾溶液褪色;二氧化硫有毒,要进行尾气处理.
(6)据题意分析红棕色固体为氧化铁,故硫酸亚铁完全分解后得四种产物.
解答 解:【探究一】:(1)由题意可知,从含有硫酸铝、硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁,加入的过量的金属A应是铁.由于铁是过量的有剩余的铁,还有生成的铜.所以,固体甲中含有的物质是Fe、Cu;由于铁不能与硫酸铝反应,所以溶液乙中的溶质是 Al2(SO4)3、FeSO4.
(2)由上述分析可知,步骤①发生的反应是铁与硫酸铜的反应,化学方程式是:Fe+CuSO4═FeSO4+Cu.步骤①向废液中加入的A是铁,检验铁是否过量的方法是继续向废液中加入稀硫酸,看是否有气泡产生;
【探究二】:
(3)步骤②中H2O2得到了Fe3+,加入过量的X发生的反应方程式为:Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质$\frac{ag×\frac{112}{160}}{10}$=0.07ag;
【探究三】:
(5)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.生成的氧化铁的质量是8g.
通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:x
Fe2O3~2xH2O
160 36x
8g 12.6g
$\frac{160}{8g}$=$\frac{36x}{12.6g}$
解得:x=7
实验中要持续通入氮气,将生成的水蒸气全部排出,否则测出的x值会偏小;
二氧化硫能使高锰酸钾溶液褪色.二氧化硫有毒,要进行尾气处理,装置D吸收二氧化硫防止污染空气.
(6)由题意可知,硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物,结合A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液的信息,可判断红色固体是Fe2O3,故硫酸亚铁完全分解后有二氧化硫、三氧化硫、水和氧化铁四种生成物.由图2可知硫酸亚铁完全分解
分两步,第一步硫酸亚铁晶体失去结晶水,第二步是硫酸亚铁转化为二氧化硫、三氧化硫和氧化铁,方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
故答案为:【探究一】:(1)Fe,Fe和Cu,Al2(SO4)3、FeSO4;
(2)Fe+CuSO4═FeSO4+Cu;继续向废液中加入稀硫酸,看是否有气泡产生;
【探究二】:(3)Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4
(4)过滤;0.07ag
【探究三】:(5)7,偏小,二氧化硫; 吸收二氧化硫防止污染空气(6)错误;2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
点评 该题考查了学生从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力,综合性强考查知识全面.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 3 CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$ 3CuO+SO3↑+2 SO2↑+O2↑ | |
| B. | 4 CuSO4 $\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2 SO3↑+2 SO2↑+O2↑ | |
| C. | 5 CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$ 5CuO+SO3↑+4 SO2↑+2 O2↑ | |
| D. | 6CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$ 6CuO+4 SO3↑+2 SO2↑+O2↑ |
| A. | 铝制品比铁制品耐腐蚀,说明铁比铝的金属活动性强 | |
| B. | 过氧化氢溶液中加入二氧化锰,立即产生气体,证明二氧化锰是该反应催化剂 | |
| C. | 纯碱的水溶液呈碱性,说明纯碱中含有烧碱 | |
| D. | 碳燃烧可生成CO或CO2,说明反应物的质量关系不同,产物可能不同 |
查阅资料】铝与氢氧化钠溶液反应,生成偏铝酸钠[NaAlO2,溶于水],反应的化学方程式为
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铁、铜不与氢氧化钠溶液反应.
【做出猜想】
猜想一:该合金中除铝外,还含有铁.
猜想二:该合金中除铝外,还含有铜.
猜想三:该合金中除铝外,还含有铜和铁.
【实验探究】该小组同学进行了如下实验.请你完成下表,写出他们所用的试剂和实验现象.
| 实验步骤 | 实验现象 | 结论或解释 |
| ①取适量的合金粉末于烧杯中,加入过量的氢氧化钠,充分反应 | 除去合金粉末中铝 | |
| ②将步骤①所得物质过滤,再向滤渣中加入过量的稀盐酸,充分反应. | 猜想三成立 |
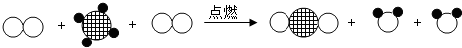
 ”表示碳原子,“
”表示碳原子,“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,该反应的化学方程式为C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O.
”表示氧原子,该反应的化学方程式为C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O. 医生给病人输液时,常用葡萄糖注射液.右图为葡萄糖注射液的部分标签图,请根据如图回答下列问题:
医生给病人输液时,常用葡萄糖注射液.右图为葡萄糖注射液的部分标签图,请根据如图回答下列问题: