题目内容
16.某同学为了研究生石灰(CaO)露置于空气中变质的情况,设计了如下实验: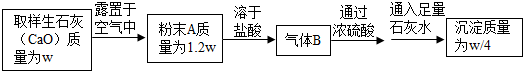
请通过计算推断粉末A的成分,并计算粉末A中CaO的质量分数.
分析 根据生石灰可以吸收空气中的水和二氧化碳而变质故A可能为CaO,Ca(OH)2,CaCO3的混合物.在A中加入盐酸,与CaCO3反应放出CO2,CO2又带水蒸气,盐酸又有挥发性,因此B的成分为H2O,CO2,HCl,当通入浓硫酸时,水吸收,HCl易溶于水也被吸收,在酸性条件下CO2在水中溶解很少,故剩余CO2与石灰水反应.
解答 解:二氧化碳和Ca(OH)2反应生成CaCO3 $\frac{w}{4}$,
设生成二氧化碳的质量为x,
Ca(OH)2+CO2═CaCO3↓+H2O,
44 100
x $\frac{w}{4}$
$\frac{44}{x}$=$\frac{100}{\frac{w}{4}}$
x=$\frac{11w}{100}$
依此类推,因为变质粉末中的CaCO3和HCl反应生成CO2,所以CaCO3是$\frac{w}{4}$,CaCO3可看作是CaO和CO2组成的,所以参与反应的CO2推出是$\frac{11w}{100}$,由于增重0.2w,所以剩下的0.09w是吸收的水,CaO和H2O生成Ca(OH)2,算出Ca(OH)2是0.37w,剩下的没反应的就是CaO了,是1.2w-0.37w-0.25w=0.58w.所以A中是0.58w的CaO,0.37w的Ca(OH)20.25w的CaCO3.
A中的CaO的质量分数为:$\frac{0.58w}{1.2w}$×100%=48.3%
故答案为:CaO,Ca(OH)2,CaCO3的混合物 48.3%.
点评 本题以生活中常见的食品干燥剂为情境角度出发,考查干燥剂是否变质的实验探究的综合性推断题,考查了CO2 Ca(OH )2 CaCO3 三者之间如何相互转化,特别是考查学生的在实验探究中推断分析能力,和平时对含碳的化合物的化学性质的积累!通过该实验探究结果引发学生在化学实验室中氢氧化钙如何正确保存,做到学以致用.

| A. |  分离KNO3和NaCl | B. |  H2还原CuO | ||
| C. |  测定空气中O2含量 | D. |  收集CO2气体 |
| A. | 将纸揉成一团 | B. | 将纸撕碎 | C. | 将纸点燃 | D. | 将纸折叠 |
| A. | 扔到水里 | B. | 扔到山上 | C. | 用土填埋 | D. | 分类处理 |
| A. | 地壳中含量居第三位的是铝元素 | B. | 铝锅可以用来长时间盛放酸性食物 | ||
| C. | 铝具有导电性,可以制作电缆 | D. | 铝原子失去3个电子变成铝离子 |