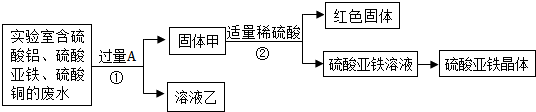
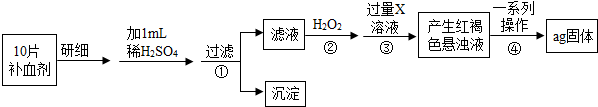
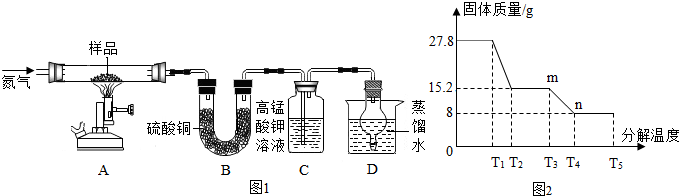
题目内容
14.含碳酸钙80%的大理石25g恰好与100g某盐酸溶液完全反应(杂质不与盐酸反应,且不溶解).求:
(1)生成二氧化碳的质量.
(2)原盐酸溶液的溶质质量分数.
(3)反应后溶液的质量.
(4)反应后所得溶液的质量分数?
分析 (1)根据反应的化学方程式,由碳酸钙的质量可计算放出二氧化碳的质量;
(2)利用方程式以及碳酸钙的质量可以求出反应的氯化氢质量,进而可得稀盐酸的质量分数;
(3)反应后溶液的质量=碳酸钙质量+盐酸质量-二氧化碳质量;
(4)根据生成的氯化钙质量以及所得溶液的质量即可求出反应后所得溶液中溶质的质量分数.
解答 解:
设生成二氧化碳的质量为x,原盐酸溶液的溶质质量分数为y,生成的氯化钙的质量是z,碳酸钙的质量为25g×80%=20g
2HCl+CaCO3═CaCl2+CO2↑+H2O
73 100 111 44
100g•y 20g z x
$\frac{73}{100g•y}$=$\frac{100}{20g}$=$\frac{111}{z}$=$\frac{44}{x}$
x=8.8g,y=14.6%,z=22.2g
反应后溶液的质量=25g×80%+100g-8.8g=111.2g
则反应后所得溶液中溶质的质量分数为$\frac{22.2g}{111.2g}$×100%≈20%
答案:
(1)生成二氧化碳的质量8.8g
(2)原盐酸溶液的溶质质量分数14.6%
(3)反应后溶液的质量111.2g.
(4)反应后所得溶液的质量分数20%.
点评 根据反应的化学方程式进行计算时,所使用的质量均为纯净物的质量,不纯物质的质量不能直接代入化学方程式进行计算.

练习册系列答案
相关题目
5.在生活中常用的“锑锅”其实是铝锅,下列对铝的认识不正确的是( )
| A. | 地壳中含量居第三位的是铝元素 | B. | 铝锅可以用来长时间盛放酸性食物 | ||
| C. | 铝具有导电性,可以制作电缆 | D. | 铝原子失去3个电子变成铝离子 |
2.已知下列变化:
A.钢铁生锈;B.铁铸成锅;C.电灯通电发光;D.水加热变为水蒸气;
E.木材燃烧;F.火药爆炸;C.蜡烛燃烧;H.食盐溶于水.
其中属于物理变化的有BCDH;
属于化学变化的有AEFG.
A.钢铁生锈;B.铁铸成锅;C.电灯通电发光;D.水加热变为水蒸气;
E.木材燃烧;F.火药爆炸;C.蜡烛燃烧;H.食盐溶于水.
其中属于物理变化的有BCDH;
属于化学变化的有AEFG.
9. 分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.某同学用如图所示形式对所学知识时行归纳,其中甲包括了乙、丙、丁…下列关系中,有错误的一组是( )
分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.某同学用如图所示形式对所学知识时行归纳,其中甲包括了乙、丙、丁…下列关系中,有错误的一组是( )
 分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.某同学用如图所示形式对所学知识时行归纳,其中甲包括了乙、丙、丁…下列关系中,有错误的一组是( )
分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.某同学用如图所示形式对所学知识时行归纳,其中甲包括了乙、丙、丁…下列关系中,有错误的一组是( )| 甲 | 乙、丙、丁… |
| A常见的氮肥 B常见的合金 C常见的营养素 D常见的碱 | 硝酸铵、尿素、氨水… 不锈钢、焊锡、生铁… 蛋白质、维生素、无机盐… 烧碱、纯碱、熟石灰 |
| A. | A | B. | B | C. | C | D. | D |
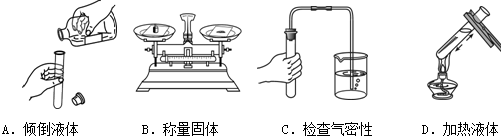
19.下列实验操作中,错误的是( )
| A. | 给试管里的液体加热,试管与桌面倾斜大约45度角 | |
| B. | 加热试管里的液体,其体积一般不超过试管容积的$\frac{2}{3}$ | |
| C. | 用托盘天平称量粗盐时,精确到0.1g | |
| D. | 加热蒸发皿里的液体,液体体积一般不超过蒸发皿容积的$\frac{2}{3}$ |