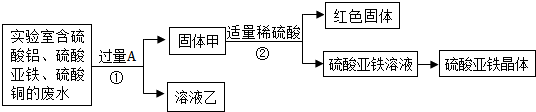
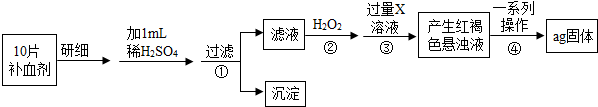
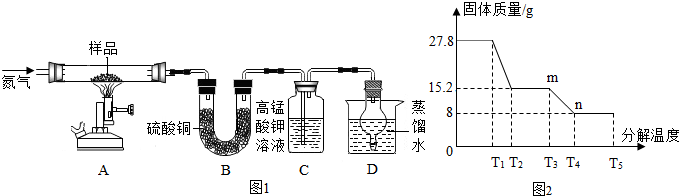
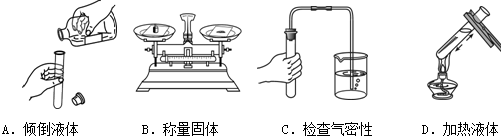
题目内容
16. 医生给病人输液时,常用葡萄糖注射液.右图为葡萄糖注射液的部分标签图,请根据如图回答下列问题:
医生给病人输液时,常用葡萄糖注射液.右图为葡萄糖注射液的部分标签图,请根据如图回答下列问题:(1)葡萄糖的化学式为C6H12O6,它是由三种元素组成,其相对分子质量是180.
(2)一瓶这样的葡萄糖注射液中含碳10g.现要配制10kg这种葡萄糖注射液,需用葡萄糖0.1kg.
分析 (1)根据葡萄糖的化学式为C6H12O6,进行分析其元素组成、计算相对分子的质量;
(2)根据题意,500mL这种葡萄糖注射液中含葡萄糖25g,据此结合化合物中某元素的质量=该化合物的质量×该元素的质量分数计算含碳的质量;根据溶质的质量分数计算配制10kg这种葡萄糖注射液,需用葡萄糖的质量.
解答 解:(1)根据葡萄糖的化学式为C6H12O6,可知葡萄糖由C,H,O三种元素组成;
葡萄糖的相对分子质量为:12×6+12+16×6=180.
(2)500mL这种葡萄糖注射液中含葡萄糖25g,含有碳元素的质量为25g×$\frac{12×6}{12×6+1×12+16×6}$100%=10g.
现要配制10kg这种葡萄糖注射液,需用葡萄糖的质量为:10kg×5%=0.1kg
故答案为:(1)三;180;(2)10,0.1.
点评 本题考查了根据化学式的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
5.在生活中常用的“锑锅”其实是铝锅,下列对铝的认识不正确的是( )
| A. | 地壳中含量居第三位的是铝元素 | B. | 铝锅可以用来长时间盛放酸性食物 | ||
| C. | 铝具有导电性,可以制作电缆 | D. | 铝原子失去3个电子变成铝离子 |
11.下列物质应用原理用化学方程式表示正确的是( )
| A. | 用适量的稀盐酸清除铁锈:Fe2O3+6HCl═2FeCl2+3H2O | |
| B. | 高温煅烧石灰石制取生石灰:CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | |
| C. | 用一氧化碳作燃料:C0+02 $\frac{\underline{\;点燃\;}}{\;}$CO2 | |
| D. | 用红磷燃烧测定空气中氧气的含量:4P+502═2P2O3 |
1.通过实验可以获取证据,得出结论.下列做法中不能获得明显证据的是( )
| A. | 为了证明氢氧化钠溶液呈碱性,在其溶液中滴加稀盐酸 | |
| B. | 为了证明铁的金属活动性比铜强,可将铁丝浸入到氯化铜溶液中 | |
| C. | 为了说明盐溶液不一定都呈中性,在碳酸钠溶液中滴加酚酞试液 | |
| D. | 为了证明汗水中含有Cl-,加入含稀硝酸的硝酸银溶液 |
8.2008年的北京奥运会倡导“绿色奥运”.“绿色奥运”需要从我做起,从身边的小事做起.下列做法中不符合“绿色”理念的是( )
| A. | 沿河岸居民的生活垃圾倒入河中 | B. | 人走不忘关灯,洗手不忘关水龙头 | ||
| C. | 同学间发电子贺卡代替赠纸质贺卡 | D. | 爱护身边的一花一草 |
6.下列有关水的描述中错误的是( )
| A. | 电解水时在正极产生氧气 | |
| B. | 水是由氢原子和氧原子构成的 | |
| C. | 可用肥皂水来区分硬水和软水 | |
| D. | 在净化水的操作中,净化程度最高的是蒸馏 |