题目内容
3.已知某Na2SO4样品中混有少量的碳酸钠,某化学实验小组取样品20克,加入50克水后搅拌,样品全部溶解.向其中逐滴加入溶质质量分数为10%的稀硫酸,直到不再产生气泡为止,共用去10%的稀硫酸9.8克,请计算:(计算结果保留一位小数)(1)样品中Na2SO4的质量分数.
(2)反应后所得溶液中溶质的质量分数.
分析 (1)根据碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,依据参加反应的硫酸质量计算参加反应的碳酸钠的质量,然后计算硫酸钠的质量分数;
(2)根据化学方程式计算反应后的溶质质量和溶液质量,然后计算溶质的质量分数.
解答 解:设样品中碳酸钠的质量为x,生成硫酸钠的质量为y,生成二氧化碳的质量为z,
Na2CO3+H2SO4═Na2SO4+CO2↑+H2O
106 98 142 44
x 9.8g×10% y z
$\frac{106}{x}$=$\frac{98}{9.8g×10%}$=$\frac{142}{y}$=$\frac{44}{z}$
x=1.06g
y=1.42g
z=0.44g
(1)样品中硫酸钠的质量分数为:$\frac{20g-1.06g}{20g}$×100%=94.7%;
(2)所得硫酸钠溶液中溶质的质量分数为:$\frac{20g-1.06g+1.42g}{20g+50g+9.8g-0.44g}$×100%=25.7%.
故答案为:(1)样品中硫酸钠的质量分数为94.7%;
(2)反应后所得溶液中溶质的质量分数为25.7%.
点评 计算反应后溶液的溶质质量分数时,要注意原混合物中的硫酸钠因溶解也是反应后溶液中溶质的一部分.根据质量守恒定律,反应质量所得溶液质量=固体混合物的质量+所加入稀硫酸的质量-反应放出二氧化碳的质量.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
14.下列实验操作中错误的是( )
| A. |  蒸发结晶 | B. |  检查装置气密性 检查装置气密性 | ||
| C. |  稀释浓硫酸 | D. |  测定溶液的pH |
11. 如图是某物质的分子模型图,下列有关说法错误的是( )
如图是某物质的分子模型图,下列有关说法错误的是( )
 如图是某物质的分子模型图,下列有关说法错误的是( )
如图是某物质的分子模型图,下列有关说法错误的是( )| A. | 该物质的化学式可表示为C2H6 | |
| B. | 该物质的一个分子中含有8个原子 | |
| C. | 该物质是由碳、氢两种元素组成的 | |
| D. | 该物质中碳、氢两种元素的质量比为1:3 |
8.常见的物质中,不属于混合物的是( )
| A. | 矿泉水 | B. | 洁净的空气 | C. | 干冰 | D. | 加碘食盐 |




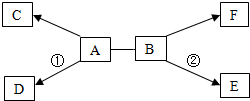 A-F是初中化学常见的六种物质,已知A广泛用于造纸、玻璃、洗涤剂生产等工业,C和F都是无色气体,且F是单质,反应①和②都有白色沉淀生成.它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两种物质能相互反应;部分反应物、生成物及反应条件未标出).请回答下列问题:
A-F是初中化学常见的六种物质,已知A广泛用于造纸、玻璃、洗涤剂生产等工业,C和F都是无色气体,且F是单质,反应①和②都有白色沉淀生成.它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两种物质能相互反应;部分反应物、生成物及反应条件未标出).请回答下列问题: