题目内容
20.某探究小组的同学用H2SO4、Na2CO3、NaOH、BaCl2四种溶液进行“复分解反应发生条件”及应用的实验探究.(1)将四种溶液两两混合,若用H2SO4与另三种溶液分别混合:
| Na2CO3 | NaOH | BaCl2 | |
| H2SO4 |
②实验中的H2SO4与NaOH混合“无明显现象”,但实际上发生了化学反应,其反应的实质是H+和OH-结合生成H2O.同理,H2SO4与BaCl2发生了化学反应,其反应的实质是Ba2+和SO${\;}_{4}^{2-}$生成硫酸钡沉淀
由此同学们总结得出:复分解反应发生的条件是有沉淀或气体或水生成.
(2)若某复分解反应的生成物中有MgCl2,请写出可能的一组的反应物是盐酸与氢氧化镁
(3)若将原四种溶液混合反应后过滤,滤液经检验呈碱性且不含Ba2+、SO42-,取滤液少量,加入BaCl2溶液,无沉淀产生,再滴入几滴酚酞试液,溶液变红色,则滤液中存在的离子有OH-.
分析 (1)①根据H2SO4与Na2CO3溶液反应的现象来分析;
②根据复分解反应的本质是溶液中的离子结合成带电离的物质、难溶的物质或挥发性气体,而使复分解反应趋于完成,进行解答;
(2)根据复分解反应的实质是:反应的两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水,进行解答;
(3)根据碱的性质与碳酸根的检验方法,进行设计检验方法.
解答 解:(1)①H2SO4与Na2CO3溶液发生化学反应是有气体产生现象明显;
②据复分解反应的本质可知:H2SO4与BaCl2发生了化学反应,其反应的实质是:Ba2+和SO${\;}_{4}^{2-}$生成硫酸钡沉淀;
(2)根据复分解反应的实质,生成物中有MgCl2,可得反应的反应物是:盐酸与氢氧化镁;
(3)根据碱的性质与碳酸根的检验方法:
取滤液少量,加入BaCl2溶液,无沉淀产生,再滴入几滴酚酞试液,溶液变红色,则证明溶液中还有OH-;
故答案为:(1)①有气体产生;
②Ba2+和SO${\;}_{4}^{2-}$生成硫酸钡沉淀;
(2)盐酸与氢氧化镁;
(3)OH-.
点评 要理解和熟记复分解反应的条件与实质,熟记常见酸、碱、盐的溶解性表,并能正确地运用物质的溶解性,方能顺利解题.

练习册系列答案
相关题目
8.在推断实验室某无色废液的成分时,四位同学得出的结论中可能合理的是( )
| A. | BaCl2、NaOH、HCl | B. | H2SO4、FeCl3、NaOH | ||
| C. | KCl、H2SO4、Ba(NO3)2 | D. | Na2SO4、NaCl、HCl |
12.关于5%的NaOH溶液,下列叙述正确的是( )
| A. | 100g水中溶解NaOH 5g | B. | 5gNaOH溶于95g水中 | ||
| C. | 溶液中NaOH与水的质量比为1:20 | D. | 溶液中NaOH与水的质量比为19:1 |

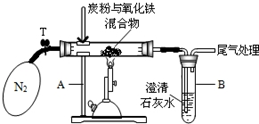 某学生小组对过量碳粉与氧化铁反应产物中气体的成分进行研究.
某学生小组对过量碳粉与氧化铁反应产物中气体的成分进行研究.