题目内容
2.实验室现有石灰石、纯碱、蒸馏水,用它们来制取火碱.请你写出所需的化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+H2O=Ca(OH)2;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.分析 根据碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠进行分析.
解答 解:碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+H2O=Ca(OH)2;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+H2O=Ca(OH)2;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
相关题目
12.下列化学方程式中正确的是( )
| A. | 铁粉与盐酸反应:2Fe+6HCl=2FeCl3+3H2↑ | |
| B. | 把铜放入氯化银中:Cu+2AgCl=CuCl2+2Ag | |
| C. | 向氯化钙溶液中滴加硝酸钾溶液:CaCl2+2KNO3=Ca(NO3)2+2KCl | |
| D. | 向氢氧化钡溶液中滴加硫酸铜溶液:Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓ |
13.有关生铁和钢的叙述正确的是( )
| A. | 生铁和钢的主要成分都是铁 | B. | 生铁和钢的主要成分都是碳 | ||
| C. | 生铁比钢硬,所以生铁的用途广 | D. | 生铁中的含碳量比钢低 |
17.能证实20℃时原KNO3的溶液是饱和溶液的事实是( )
| A. | 降温到10℃时有KNO3晶体析出 | |
| B. | 蒸发掉10克水,有KNO3晶体析出 | |
| C. | 加热到30℃后,再加入KNO3晶体仍能继续溶解 | |
| D. | 在20℃时,向上述KNO3溶液中加入少量KNO3晶体,溶液的质量不变. |
7.如图为硫酸钠和氯化钠的溶解度曲线.下列说法正确的是( )
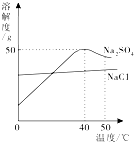

| A. | 温度升高,两种物质的溶解度都增大 | |
| B. | 可用降温结晶的方法提纯含少量Na2SO4的NaCl | |
| C. | 50℃的Na2SO4饱和溶液降到40℃时有晶体析出 | |
| D. | 40℃时,75g饱和Na2SO4溶液中含25g Na2SO4 |
14.将pH试纸润湿后,测定盐酸的pH对测得的数值说法正确的是( )
| A. | 大于实际值 | B. | 等于实际值 | C. | 小于实际值 | D. | 无法确定 |
11.石灰石的主要成分为CaCO3,所含杂质不溶于水,也不参加反应.某化学兴趣小组为了测定石灰石中CaCO3的质量分数,进行了以下探究实验:称石灰石样品二份,分别放入大烧杯中,第一个烧杯中加入50克稀盐酸,第二个烧杯中放入100克同样的稀盐酸,充分反应至不再有气泡产生时称量残留物质量,有关数据如下表.
求:(1)二个烧杯中产生CO2的质量(填入上表);
(2)石灰石样品中CaCO3的质量分数.(精确到0.1%)
| 各物质的质量 | 第一个烧杯 | 第二个烧杯 |
| 石灰石样品质量 | 12g | 12g |
| 稀盐酸质量 | 50g | 100g |
| 烧杯残留物质量 | 58.7g | 107.6g |
| 产生的CO2质量 | - | - |
(2)石灰石样品中CaCO3的质量分数.(精确到0.1%)
1.小华想测定Cu-Zn合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器.为了测定该合金的组成,小华称取10g该合金粉末,在粉末中连续三次加入稀盐酸反应.每加一次盐酸,小华记录所得气体的质量,实验数据如下,从下表数据分析:
①小华用10g合金粉末总共收集到氢气0.20g
②求出该合金中铜的质量分数.(H-1 Cu-64 Zn-65 Ag-108 Cl-35.5)
| 第一次 | 第二次 | 第三次 | |
| 连续加入盐酸的体积/mL | 10 | 10 | 10 |
| 生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
②求出该合金中铜的质量分数.(H-1 Cu-64 Zn-65 Ag-108 Cl-35.5)