题目内容
15.某一杯长期放置的食盐水,若上部的密度为ag/cm3,则下部的密度为( )| A. | 大于ag/cm3 | B. | 等于ag/cm3 | C. | 小于ag/cm3 | D. | 无法判断 |
分析 溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物;均一性是指各部分的性质完全相同
解答 解:由于溶液是均一的,各部分性质都相同,上部的密度是ag/cm3,所以下部溶液的密度也是ag/cm3.
故选B.
点评 本题很简单,充分理解溶液的本质特征是解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列变化属于化学变化的是( )
| A. | 石油分馏 | B. | 铁丝生锈 | C. | 干冰升华 | D. | 汽油挥发 |
6.一些食物的近似pH如下表:
(1)苹果汁和葡萄汁相比较,酸性较强的是苹果汁;
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的食物是玉米粥;
(3)鸡蛋壳中含有CaCO3,以前因胃酸过多导致胃痛时,有人吃鸡蛋壳粉,其原因是(用化学方程式表示)CaCO3+2HCl═CaCl2+H2O+CO2↑.现今,许多治疗胃酸过多的药品的有效成分是氢氧化铝,而不是CaCO3,请提出一种理由说明为什么氢氧化铝优越于CaCO3患胃溃疡的病人服用含碳酸钙的药物会引起胃穿孔.
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米 |
| PH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的食物是玉米粥;
(3)鸡蛋壳中含有CaCO3,以前因胃酸过多导致胃痛时,有人吃鸡蛋壳粉,其原因是(用化学方程式表示)CaCO3+2HCl═CaCl2+H2O+CO2↑.现今,许多治疗胃酸过多的药品的有效成分是氢氧化铝,而不是CaCO3,请提出一种理由说明为什么氢氧化铝优越于CaCO3患胃溃疡的病人服用含碳酸钙的药物会引起胃穿孔.
7.如图为硫酸钠和氯化钠的溶解度曲线.下列说法正确的是( )
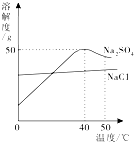

| A. | 温度升高,两种物质的溶解度都增大 | |
| B. | 可用降温结晶的方法提纯含少量Na2SO4的NaCl | |
| C. | 50℃的Na2SO4饱和溶液降到40℃时有晶体析出 | |
| D. | 40℃时,75g饱和Na2SO4溶液中含25g Na2SO4 |
4.下列实验操作中,错误的是( )
| A. |  检查气密性 | B. |  验满氧气 | C. |  称量固体 | D. |  蒸发食盐水 |
14.合金和纯金属相比,一般来说,除以下( )以外,其余均增强,因此,合金有更广泛的用途.
| A. | 熔点更高 | B. | 硬度 | C. | 抗腐蚀性 | D. | 强度 |