题目内容
18.下列金属与稀硫酸反应最剧烈的是( )| A. | 铜 | B. | 镁 | C. | 铁 | D. | 锌 |
分析 根据金属活动性顺序表 可知,氢前金属能够置换酸中的氢,金属位置越靠前,与酸反应越剧烈.
可知,氢前金属能够置换酸中的氢,金属位置越靠前,与酸反应越剧烈.
解答 解:Cu、Mg、Zn、Fe四种金属中,金属的活动性由强到弱的顺序是Mg>Zn>Fe>H>Cu,所以分别放在相同的稀硫酸中,反应最剧烈的是Mg;
故选:B.
点评 解金属活动性顺序表及其应用,以及金属的性质是解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.一些食物的近似pH如下表:
(1)苹果汁和葡萄汁相比较,酸性较强的是苹果汁;
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的食物是玉米粥;
(3)鸡蛋壳中含有CaCO3,以前因胃酸过多导致胃痛时,有人吃鸡蛋壳粉,其原因是(用化学方程式表示)CaCO3+2HCl═CaCl2+H2O+CO2↑.现今,许多治疗胃酸过多的药品的有效成分是氢氧化铝,而不是CaCO3,请提出一种理由说明为什么氢氧化铝优越于CaCO3患胃溃疡的病人服用含碳酸钙的药物会引起胃穿孔.
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米 |
| PH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的食物是玉米粥;
(3)鸡蛋壳中含有CaCO3,以前因胃酸过多导致胃痛时,有人吃鸡蛋壳粉,其原因是(用化学方程式表示)CaCO3+2HCl═CaCl2+H2O+CO2↑.现今,许多治疗胃酸过多的药品的有效成分是氢氧化铝,而不是CaCO3,请提出一种理由说明为什么氢氧化铝优越于CaCO3患胃溃疡的病人服用含碳酸钙的药物会引起胃穿孔.
13.有关生铁和钢的叙述正确的是( )
| A. | 生铁和钢的主要成分都是铁 | B. | 生铁和钢的主要成分都是碳 | ||
| C. | 生铁比钢硬,所以生铁的用途广 | D. | 生铁中的含碳量比钢低 |
7.如图为硫酸钠和氯化钠的溶解度曲线.下列说法正确的是( )
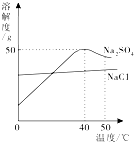

| A. | 温度升高,两种物质的溶解度都增大 | |
| B. | 可用降温结晶的方法提纯含少量Na2SO4的NaCl | |
| C. | 50℃的Na2SO4饱和溶液降到40℃时有晶体析出 | |
| D. | 40℃时,75g饱和Na2SO4溶液中含25g Na2SO4 |

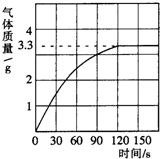 我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.
我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.