题目内容
11.如图所示实验基本操作中,错误的是( )| A. | 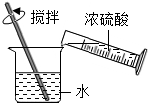 稀释浓硫酸 | B. | 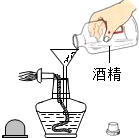 添加酒精 | ||
| C. | 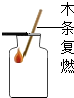 氧气验满 | D. | 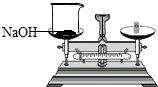 称氢氧化钠固体 |
分析 A、根据浓硫酸的稀释方法进行分析判断.
B、从往酒精灯里添加酒精要使用漏斗,防止酒精洒到外面去分析.
C、氧气的验满方法是把带火星的木条放在瓶口来验满,如果带火星的木条在瓶口能复燃,则证明该瓶氧气已经收集满了.
D、左放物质,右放砝码;易潮解的药品,必须放在玻璃器皿上.
解答 解:A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中,图中所示操作正确;
B、往酒精灯里添加酒精要使用漏斗,防止酒精洒到外面,图中所示操作正确;
C、氧气的验满方法是把带火星的木条放在瓶口来验满,图中操作错误;
D、具有腐蚀性的氢氧化钠放在烧杯里称量,且“左物右码”,图中所示操作正确;
故选:C.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
1.据氯化钠和硝酸钾的溶解度表,回答下列问题:(溶解度单位为克)
(1)KNO3和NaCl具有相同溶解度时的温度范围应当是20℃~30℃.
(2)在50℃时,向100g水中加入90gKNO3,充分搅拌后所得溶液质量为185.5克.
(3)在10℃时,NaCl饱和溶液溶质的质量分数大于KNO3饱和溶液溶质的质量分数.(填“大于”、“等于”或“小于”)
(4)欲使硝酸钾从其常温下的饱和溶液里迅速结晶出来,应采取的办法是C
A、冷却硝酸钾的饱和溶液 B、常温下使水分蒸发
C、先加热蒸发掉一部分水,然后降温 D、升高饱和溶液的温度.
| 温度 溶解度 物质 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
| NaCl | 35.8 | 36 | 36.3 | 36.6 | 37.0 | 37.3 | 37 |
| KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
(2)在50℃时,向100g水中加入90gKNO3,充分搅拌后所得溶液质量为185.5克.
(3)在10℃时,NaCl饱和溶液溶质的质量分数大于KNO3饱和溶液溶质的质量分数.(填“大于”、“等于”或“小于”)
(4)欲使硝酸钾从其常温下的饱和溶液里迅速结晶出来,应采取的办法是C
A、冷却硝酸钾的饱和溶液 B、常温下使水分蒸发
C、先加热蒸发掉一部分水,然后降温 D、升高饱和溶液的温度.
2.能用作氮肥的是( )
| A. | KCl | B. | Na2SO4 | C. | Ca2(PO4)2 | D. | NH4NO3 |
16.以下有关化学知识推理正确的是( )
| A. | 氢氧化钠能和二氧化硫、二氧化碳、三氧化硫反应,但不能和一氧化碳反应 | |
| B. | 酸中都含有氢元素,所以含有氢元素的化合物一定是酸 | |
| C. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| D. | 硝酸钾、氯化铵的溶解度随温度的升高而增大,所以固体的溶解度都随温度的升高而增大 |
3.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
Ⅰ.定性探究
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【猜想】针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.你认为不合理的猜想是哪一种并说出理由猜想四;H2SO4和NaOH在溶液中不能共存.
【继续实验】
(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各组同学取烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出上述三个实验探究中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中明显的一处错误是pH试纸浸入溶液中;
(2)实验方案探究中也有一个是不合理的,不合理的原因是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
II.定量探究
取上述【演示实验】反应后烧杯中的溶液100g,设计如图实验:

计算反应后溶液中Na2SO4的质量分数是多少?(请列出计算过程)
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
Ⅰ.定性探究
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【猜想】针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.你认为不合理的猜想是哪一种并说出理由猜想四;H2SO4和NaOH在溶液中不能共存.
【继续实验】
(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各组同学取烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 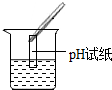 | 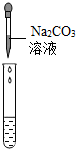 |  |
| 实验现象 | 试纸变色,比照比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出上述三个实验探究中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中明显的一处错误是pH试纸浸入溶液中;
(2)实验方案探究中也有一个是不合理的,不合理的原因是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
II.定量探究
取上述【演示实验】反应后烧杯中的溶液100g,设计如图实验:

计算反应后溶液中Na2SO4的质量分数是多少?(请列出计算过程)
20.物质的性质决定用途.下列几种常见物质的性质、用途不一致的是( )
| A. | 氮气--性质稳定--保护气 | B. | 石墨--导电性--作电极 | ||
| C. | 酒精--可燃性--消毒剂 | D. | 干冰--升华吸热--人工降雨 |
