题目内容
3.某化学兴趣小组的同学准备对氢氧化钠的性质进行探究,请你参与:他们设计的方案如图所示,并进行实验;
(1)取A溶液少量于试管中,滴人酚酞溶液,现象为酚酞试液变红色;
(2)向B中通人CO2,无明显现象;
[提出问题]CO2与Na0H发生反应了吗?
[查阅资料]①过量的CO2通人NaOH溶液时,生成NaHCO3;②Ca(HCO3)可溶于水;(3)NaHCO3+NaOH═Na2CO3+H2O;
[实验与分析]甲乙同学都分别取F溶液进行实验;
甲同学:向F中滴人硝酸钙溶液,无明显现象,CO2与NaOH发生了反应.
乙同学:向F中滴入稀盐酸,有气泡产生,CO2与NaOH发生了反应;
大家分析后认为,乙同学的实验和结论正确;
①甲同学的判断错误的原因是如果二氧化碳和氢氧化钠不发生反应,向F中滴人硝酸钙溶液,也无明显现象.
②乙同学实验中发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
分析 氢氧化钠溶液显碱性,能使酚酞试液变红色;
二氧化碳不能和硝酸钙反应,氢氧化钠不能和硝酸钙反应,碳酸氢钠不能和硝酸钙反应;
二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳.
解答 解:(1)因为氢氧化钠溶液显碱性,取氢氧化钠溶液少量于试管中,滴人酚酞溶液时,酚酞试液变红色.
故填:酚酞试液变红色.
(2)①二氧化碳不能和硝酸钙反应,氢氧化钠不能和硝酸钙反应,因此甲同学的判断错误的原因是:如果二氧化碳和氢氧化钠不发生反应,向F中滴人硝酸钙溶液,也无明显现象.
故填:如果二氧化碳和氢氧化钠不发生反应,向F中滴人硝酸钙溶液,也无明显现象.
②乙同学实验中碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.如图所示是某反应前后的微观示意图,“ ”和“
”和“ ”表示两种不同的原子.下列有关该反应的说法正确的是( )
”表示两种不同的原子.下列有关该反应的说法正确的是( )

 ”和“
”和“ ”表示两种不同的原子.下列有关该反应的说法正确的是( )
”表示两种不同的原子.下列有关该反应的说法正确的是( )
| A. | 三种物质前面的系数比为4:1:2 | |
| B. | 该反应前后元素的化合价都没有发生改变 | |
| C. | 该反应有单质生成 | |
| D. | 反应前后原子的种类和数目没有发生改变 |
8.将含有HCl、CO2、CO、O2的混合气体依次作如下处理:(1)通过饱和的NaHCO3溶液;(2)通过足量的石灰水;(3)通过灼热的铜网;(4)通过灼热的CuO (假定各步参加反应气体均无剩余),最后剩下的气体物质有( )
| A. | CO | B. | CO2 | C. | O2 | D. | 什么气体都没有 |
8.老师带领五班的同学们探究CO2与碱的反应,请你一同参与.

Ⅰ.同学们用如图1所示装置进行实验,验证CO2与NaOH、Ca(OH)2都能发生反应.
(1)分别向甲、乙两个瓶中注入少量、等体积的两种溶液,观察实验现象.甲中反应的化学方程式是2NaOH+CO2═Na2CO3+H2O.说明CO2能与Ca(OH)2反应的实验现象是氢氧化钙溶液变浑浊.
(2)下列实验现象中,一定能说明“CO2与NaOH发生了化学反应”的是bc(填序号).
a.U型管中红墨水左低右高 b.U型管中红墨水左高右低 c.U型管中红墨水液面没有发生改变.
Ⅱ.博宇在另外的实验中,向石灰水中通入二氧化碳(如图2所示),出现了意想不到的现象;有的石灰水未变浑浊;有的出现浑浊后又变澄清(沉淀消失).
【提出问题】实验中,出现意想不到现象的原因是什么呢?
【猜想与假设】
a.石灰水未变浑浊,是因为二氧化碳中混有少量氯化氢气体.
b.石灰水未变浑浊,是因为石灰水的浓度太小,或通入二氧化碳气体太少.
c.石灰水出现浑浊后又变澄清,与石灰水的浓度、通入二氧化碳的时间有关.
【进行实验】如图3,①所用盐酸与分组实验相同;②CO2在饱和NaHCO3溶液中的溶解度非常小.
步骤1:分别取一定体积的饱和澄清石灰水与一定体积的蒸馏水混合配制成50mL溶液.
步骤2:分别向50mL溶液中通入一段时间的二氧化碳,记录现象.
【解释与结论】
(1)实验中,所用石灰水为饱和溶液的是①(填实验序号).
(2)饱和NaHCO3溶液的作用是除去氯化氢气体.
(3)通过实验分析,猜想a不成立(填“成立”或“不成立”),
【反思与评价】
(4)向澄清的石灰水中通入二氧化碳,为避免出现“意想不到的现象”,你的建议所用石灰水的浓度不能太小,通入二氧化碳的时间不能太短,也不能太长.

Ⅰ.同学们用如图1所示装置进行实验,验证CO2与NaOH、Ca(OH)2都能发生反应.
(1)分别向甲、乙两个瓶中注入少量、等体积的两种溶液,观察实验现象.甲中反应的化学方程式是2NaOH+CO2═Na2CO3+H2O.说明CO2能与Ca(OH)2反应的实验现象是氢氧化钙溶液变浑浊.
(2)下列实验现象中,一定能说明“CO2与NaOH发生了化学反应”的是bc(填序号).
a.U型管中红墨水左低右高 b.U型管中红墨水左高右低 c.U型管中红墨水液面没有发生改变.
Ⅱ.博宇在另外的实验中,向石灰水中通入二氧化碳(如图2所示),出现了意想不到的现象;有的石灰水未变浑浊;有的出现浑浊后又变澄清(沉淀消失).
【提出问题】实验中,出现意想不到现象的原因是什么呢?
【猜想与假设】
a.石灰水未变浑浊,是因为二氧化碳中混有少量氯化氢气体.
b.石灰水未变浑浊,是因为石灰水的浓度太小,或通入二氧化碳气体太少.
c.石灰水出现浑浊后又变澄清,与石灰水的浓度、通入二氧化碳的时间有关.
【进行实验】如图3,①所用盐酸与分组实验相同;②CO2在饱和NaHCO3溶液中的溶解度非常小.
步骤1:分别取一定体积的饱和澄清石灰水与一定体积的蒸馏水混合配制成50mL溶液.
步骤2:分别向50mL溶液中通入一段时间的二氧化碳,记录现象.
| 实验序号 | V饱和石灰水/mL | V蒸馏水/mL | 出现现象所需时间/s | |||
| 开始浑浊 | 明显浑浊 | 沉淀减少 | 是否澄清 | |||
| ① | 50 | 0 | 19 | 56 | 366 | 持续通入CO28min以上,沉淀不能完全消失 |
| ③ | 30 | 20 | 25 | 44 | 128 | |
| ④ | 20 | 30 | 27 | 35 | 67 | 89s后完全澄清 |
| ⑤ | 10 | 40 | 通3min以上,均无明显现象 | |||
(1)实验中,所用石灰水为饱和溶液的是①(填实验序号).
(2)饱和NaHCO3溶液的作用是除去氯化氢气体.
(3)通过实验分析,猜想a不成立(填“成立”或“不成立”),
【反思与评价】
(4)向澄清的石灰水中通入二氧化碳,为避免出现“意想不到的现象”,你的建议所用石灰水的浓度不能太小,通入二氧化碳的时间不能太短,也不能太长.
15.有关NaOH与CO2反应的探究
探究一:检验NaOH固体样品露置空气中一段时间后的成分
【查阅资料】Na2CO3溶液是碱性,KCl溶液、BaCl2溶液显中性、BaCO3难溶于水.
(1)检验样品是否变质a检验样品成分中是否含碳酸根的实验方法(操作、现象及结论):
(2)检验样品是否完全变质,实验操作:取样品加水溶解,先加过量的C(填编号,下同)再滴加E.
A.盐酸B.KCl溶液C.BaCl2溶液D.Ba(OH)2溶液E.酚酞试液.
探究一:检验NaOH固体样品露置空气中一段时间后的成分
【查阅资料】Na2CO3溶液是碱性,KCl溶液、BaCl2溶液显中性、BaCO3难溶于水.
(1)检验样品是否变质a检验样品成分中是否含碳酸根的实验方法(操作、现象及结论):
| 操作 | 现象 | 结论 |
A.盐酸B.KCl溶液C.BaCl2溶液D.Ba(OH)2溶液E.酚酞试液.
12.下列反应属于分解反应的是( )
| A. | 铜+氧气→氧化铜 | B. | 酒精+氧气→水+二氧化碳 | ||
| C. | 锌+硫酸→硫酸锌+氢气 | D. | 碱式碳酸铜→氧化铜+水+二氧化碳 |
13. C02与NaOH溶液能发生反应,但看不到明显现象.某化学兴趣小组为验证CO2与NaOH溶液发生了反应,进行如下探究活动.
C02与NaOH溶液能发生反应,但看不到明显现象.某化学兴趣小组为验证CO2与NaOH溶液发生了反应,进行如下探究活动.
【查阅资料】
(1)CO2与NaOH反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
【设计实验】
(2)方案一:
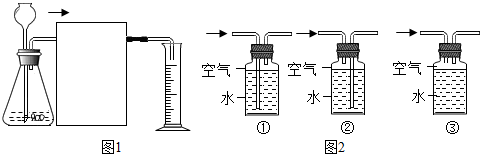
(3)方案二:接如图所示装置进行实验.
【反思与评价】
(4)有同学认为方案二根据实验现象不能得出“CO2与NaOH溶液发生了反应”的结论,还应再做对比实验,理由是二氧化碳可以溶于水.
 C02与NaOH溶液能发生反应,但看不到明显现象.某化学兴趣小组为验证CO2与NaOH溶液发生了反应,进行如下探究活动.
C02与NaOH溶液能发生反应,但看不到明显现象.某化学兴趣小组为验证CO2与NaOH溶液发生了反应,进行如下探究活动.【查阅资料】
(1)CO2与NaOH反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
【设计实验】
(2)方案一:
| 实验操作 | 实验现象 | 结论 |
| 往盛有NaOH溶液的试管中通人CO2,然后滴人足量的氯化钙溶液 | 产生了沉淀 | CO2与NaOH溶液发生了反应 |
| 1实验操作 | 实验现象 | 结论 |
| 将氢氧化钠溶液滴入广口瓶中,然后打开活塞 | 烧杯中的水吸入集气瓶中 | CO2与NaOH溶液发生了反应 |
(4)有同学认为方案二根据实验现象不能得出“CO2与NaOH溶液发生了反应”的结论,还应再做对比实验,理由是二氧化碳可以溶于水.
 “化学反应条件的控制是实验的灵魂”,某校科学兴趣小组在老师指导下,进行了“影响比较金属活动性因素”的实验,请你帮助回答下列问题:
“化学反应条件的控制是实验的灵魂”,某校科学兴趣小组在老师指导下,进行了“影响比较金属活动性因素”的实验,请你帮助回答下列问题: