题目内容
14.工业上利用电石(CaC2)制备高纯碳酸钙的流程如下:
已知:①CaC2+2H2O=Ca(OH)2+C2H2↑
②CaCl2+H2O+CO2+2NH3=CaCO3↓+2NH4Cl
(1)乙炔(C2H2)是一种常见的燃料,写出乙炔完全燃烧的化学方程式2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.
(2)该流程中可循环使用的物质是氯化铵溶液(填名称).
(3)电石长期露置于空气中,最终所得固体中一定含有碳酸钙,用化学方程式解释存在该物质的原因CO2+Ca(OH)2=CaCO3↓+H2O;因此电石应该密封保存.
分析 (1)乙炔完全燃烧生成水和二氧化碳;
(2)根据工艺流程中可循环使用的物质;
(3)电石长期露置于空气中,能和空气中的水反应生成氢氧化钙,氢氧化钙能和空气中的二氧化碳反应生成碳酸钙和水.
解答 解:(1)乙炔完全燃烧生成水和二氧化碳,反应的化学方程式为:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.
故填:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.
(2)由该流程可知,溶液A是氯化铵溶液,可以和残渣反应,因此可循环使用的物质是氯化铵溶液.
故填:氯化铵溶液.
(3)电石长期露置于空气中,能和空气中的水反应生成氢氧化钙,氢氧化钙能和空气中的二氧化碳反应生成碳酸钙和水,氢氧化钙和二氧化碳反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
由于电石长期露置于空气中容易变质,因此电石应该密封保存.
故填:CO2+Ca(OH)2=CaCO3↓+H2O;密封.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
6.下列物质与其对应的用途不相符的是( )
| A. | 干冰用于人工降雨 | B. | 氮气用作保护气 | ||
| C. | 氢氧化钠用于治疗胃酸过多 | D. | 熟石灰用于改良酸性土壤 |
3.下列知识归纳有错误的一组是( )
| A.物质组成 | B.物质构成 |
| 高锰酸钾、锰酸钾-组成元素相同 由一种元素组成的纯净物-单质 | 质子数-决定元素的种类 最外层电子数-决定元素的化学性质 |
| C.物质性质 | D.物质变化 |
| CO和CO2-都具有还原性 镁、铝、锌、铁-都能与稀盐酸反应 | 氢氧化钠去油污-化学变化 洗洁精去油污-物理变化 |
| A. | A | B. | B | C. | C | D. | D |
4.下列实验操作正确的是( )
| A. |  CO2验满 | B. |  测溶液酸碱度 | C. |  收集O2 | D. |  取用固体药品 |
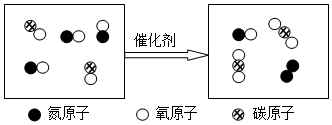
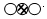 ”表示的物质属于②.(选填序号).
”表示的物质属于②.(选填序号).

