题目内容
14.200g赤铁矿(主要成分是Fe2O3)中含有的铁元素的质量为112g.则此铁矿石中Fe2O3的质量分数为80%.分析 根据化合物的质量=该化合物中某元素的质量÷该元素的质量分数,进行分析解答.
解答 解:200g赤铁矿(主要成分是Fe2O3)中含有的铁元素的质量为112g,此铁矿石中Fe2O3的质量为112g÷($\frac{56×2}{56×2+16×3}$×100%)=160g,则此铁矿石中Fe2O3的质量分数为$\frac{160g}{200g}$×100%=80%.
故答案为:80%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
5.施肥是农业增产的重要手段.下列属于复合肥料的是( )
| A. | Ca3(PO4)2 | B. | KNO3 | C. | NH4NO3 | D. | K2CO3 |
9.如图是物质间发生化学反应的颜色变化,其中X是( )


| A. | 稀硫酸 | B. | 稀盐酸 | C. | 硫酸钠溶液 | D. | 澄清石灰水 |
19.可用于治疗胃酸(含有盐酸)过多的物质是( )
| A. | NaCl | B. | CaO | C. | Mg(OH)2 | D. | NaOH |
6.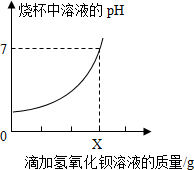 测定某品牌洁厕灵中硫酸质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加25g溶质质量分数为17.1%的氢氧化钡溶液,反应过程中滴入氢氧化钡溶液的质量和烧杯中溶液pH变化的部分数据如表所示:
测定某品牌洁厕灵中硫酸质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加25g溶质质量分数为17.1%的氢氧化钡溶液,反应过程中滴入氢氧化钡溶液的质量和烧杯中溶液pH变化的部分数据如表所示:
求:
①当烧杯中溶液的pH=7时,加入氢氧化钡溶液质量X=20g.
②测得20g该品牌的洁厕灵溶液中硫酸的质量是1.96g.(根据化学方程式计算)
 测定某品牌洁厕灵中硫酸质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加25g溶质质量分数为17.1%的氢氧化钡溶液,反应过程中滴入氢氧化钡溶液的质量和烧杯中溶液pH变化的部分数据如表所示:
测定某品牌洁厕灵中硫酸质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加25g溶质质量分数为17.1%的氢氧化钡溶液,反应过程中滴入氢氧化钡溶液的质量和烧杯中溶液pH变化的部分数据如表所示:| 滴加氢氧化钡溶液的质量/g | 5 | 10 | X | 25 |
| 烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 | 4.66 |
①当烧杯中溶液的pH=7时,加入氢氧化钡溶液质量X=20g.
②测得20g该品牌的洁厕灵溶液中硫酸的质量是1.96g.(根据化学方程式计算)

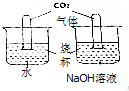 课外小组同学为探究二氧化碳的性质设计如图实验:
课外小组同学为探究二氧化碳的性质设计如图实验: