题目内容
6.五味子甲素是( C24H32O6)五味子的干燥成熟果实提取物,下列关于五味子甲素的说法正确的是( )| A. | 五味子甲素中碳氢氧元素的质量比为12:61:3 | |
| B. | 相对分子质量为416 | |
| C. | 保持五味子甲素的化学性质的微粒为C、H、O | |
| D. | 五味子甲素中氢元素的质量分数最高 |
分析 A.根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析;
B.根据相对分子质量的计算方法来分析;
C.根据物质的构成来分析;
D.
解答 解:A.五味子甲素中碳、氢、氧元素的质量比为(12×24):(1×32):(16×6)=9:1:3,故错误;
B.五味子甲素( C24H32O6)的相对分子质量=12×24+1×32+16×6=416,故正确;
C.五味子甲素是由五味子甲素分子构成的,因此五味子甲素分子保持其化学性质,故错误;
D.五味子甲素中碳、氢、氧元素的质量比为(12×24):(1×32):(16×6)=9:1:3,可见其中碳元素的质量分数最大,故错误.
故选B.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
14.某同学由下表所示的NH4Cl的溶解度得到以下结论,正确的是( )
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度/g | 40 | 50 | 58 | 68 |
| A. | 氯化铵的溶解度是40g. | |
| B. | 20℃时,氯化铵饱和溶液中氯化铵的质量分数是25% | |
| C. | 40℃时,150g氯化铵溶液中氯化铵的质量为50g. | |
| D. | 80℃时,84g氯化铵饱和溶液降温至60℃时有5g氯化铵析出 |
1.要除去下列物质中的少量杂质(括号内物质为杂质),下列实验方案设计中,不合理的是( )
| A. | NaCl溶液(Na2SO4):加入过量的BaCl2溶液,过滤 | |
| B. | N2 (O2):将气体缓缓通过灼热的铜 | |
| C. | CaCO3 (CaCl2):加水溶解一过滤一洗涤一干燥 | |
| D. | KCl溶液(K2CO3):加入适量的稀盐酸 |
11.为测定氯化钠和碳酸钠混合物的组成情况,某研究小组进行了如下实验.

(1)在滴加氯化钡溶液的过程中,烧杯中各溶质质量的变化情况为氯化钠质量增大,碳酸钠质量减小.
(2)混合物中氯化钠的质量分数为多少?

(1)在滴加氯化钡溶液的过程中,烧杯中各溶质质量的变化情况为氯化钠质量增大,碳酸钠质量减小.
(2)混合物中氯化钠的质量分数为多少?
2. 某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
【提出问题】氢氧化钠与稀盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量.
【实验设计】甲、乙、丙三位同学分别设计了如下表所示实验方案,请你帮他们完成实验报告.
【结论】氢氧化钠与稀盐酸发生了化学反应.
【评价反思】你认为实验设计方案不合理的同学是乙,理由氢氧化钠固体溶于水也会放出热量.
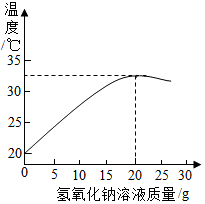
【拓展应用】如图表示溶质质量分数为8%的氢氧化钠溶液遇20g某稀盐酸发生反应后溶液温度的变化情况.
(1)根据曲线判断,当加入氢氧化钠溶液的质量为20g时,反应恰好完全进行.
(2)当加入15g氢氧化钠溶液时,所得溶液中的溶质为NaCl和HCl(写化学式).
(3)计算此稀盐酸中溶质的质量分数(写出计算过程).
 某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.【提出问题】氢氧化钠与稀盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量.
【实验设计】甲、乙、丙三位同学分别设计了如下表所示实验方案,请你帮他们完成实验报告.
| 同 学 | 实 验 操作 | 现 象 |
| 甲 | 将稀盐酸慢慢滴入加有酚酞的NaOH溶液,并不断搅拌 | 溶液颜色的变化是红色逐渐变浅直至褪去 |
| 乙 | 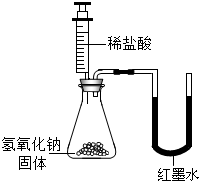 | U型玻璃管中左边的红墨水液面下降(所加稀盐酸的体积忽略不计) |
| 丙 | 用pH试纸pH试纸测定氢氧化钠溶液的pH,向其中滴加过量稀盐酸,再测定溶液的pH | 最后溶液的pH<<(填“>7”“<7”或“=7”) |
【评价反思】你认为实验设计方案不合理的同学是乙,理由氢氧化钠固体溶于水也会放出热量.
【拓展应用】如图表示溶质质量分数为8%的氢氧化钠溶液遇20g某稀盐酸发生反应后溶液温度的变化情况.
(1)根据曲线判断,当加入氢氧化钠溶液的质量为20g时,反应恰好完全进行.
(2)当加入15g氢氧化钠溶液时,所得溶液中的溶质为NaCl和HCl(写化学式).
(3)计算此稀盐酸中溶质的质量分数(写出计算过程).




