题目内容
2. 某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.【提出问题】氢氧化钠与稀盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量.
【实验设计】甲、乙、丙三位同学分别设计了如下表所示实验方案,请你帮他们完成实验报告.
| 同 学 | 实 验 操作 | 现 象 |
| 甲 | 将稀盐酸慢慢滴入加有酚酞的NaOH溶液,并不断搅拌 | 溶液颜色的变化是红色逐渐变浅直至褪去 |
| 乙 | 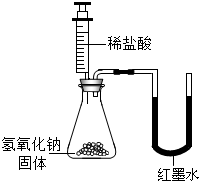 | U型玻璃管中左边的红墨水液面下降(所加稀盐酸的体积忽略不计) |
| 丙 | 用pH试纸pH试纸测定氢氧化钠溶液的pH,向其中滴加过量稀盐酸,再测定溶液的pH | 最后溶液的pH<<(填“>7”“<7”或“=7”) |
【评价反思】你认为实验设计方案不合理的同学是乙,理由氢氧化钠固体溶于水也会放出热量.
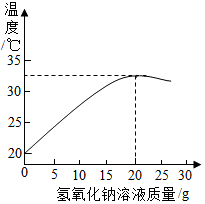
【拓展应用】如图表示溶质质量分数为8%的氢氧化钠溶液遇20g某稀盐酸发生反应后溶液温度的变化情况.
(1)根据曲线判断,当加入氢氧化钠溶液的质量为20g时,反应恰好完全进行.
(2)当加入15g氢氧化钠溶液时,所得溶液中的溶质为NaCl和HCl(写化学式).
(3)计算此稀盐酸中溶质的质量分数(写出计算过程).
分析 酚酞试液遇到碱溶液变红,遇到中性溶液或酸性溶液不变色,所以氢氧化钠中滴加盐酸使,当把氢氧化钠反应完了,溶液就会变为无色,根据方程式的书写注意事项写出方程式;氢氧化钠固体溶于水会放出大量的热,由于热胀冷缩,所以U型玻璃管中左侧下降右侧上升;测定溶液的pH最简单的方法是使用pH试纸;中性溶液或酸性溶液都不能使酚酞试液变色;由于乙同学用的是氢氧化钠固体溶于水,由于氢氧化钠固体溶于水会放出热量,到底热量是氢氧化钠与盐酸反应放出的,还是氢氧化钠固体溶于水放出的,无法判断,所以说法错误;根据氢氧化钠与盐酸的反应进行分析,盐酸与氢氧化钠反应放出热量,二者恰好完全反应时放出的热量最多,当再加入氢氧化钠时,由于不再放出热量而氢氧化钠溶液的温度较低,溶液混合而导致温度下降,根据二者反应的化学方程式以及物质间的质量关系即可求得盐酸的溶质质量分数.
解答 解:【实验设计】酚酞试液遇到碱溶液变红,遇到中性溶液或酸性溶液不变色,所以氢氧化钠中滴加盐酸使,当把氢氧化钠反应完了,溶液就会变为无色;反应物是氢氧化钠和盐酸,生成物是氯化钠和水,所以方程式是:HCl+NaOH=NaCl+H2O;
氢氧化钠固体溶于水会放出大量的热,氢氧化钠与盐酸反应也能放出热量,会导致瓶内温度升高,由于热胀冷缩,所以U型玻璃管中液面左侧下降右侧上升;
测定溶液的pH最简单的方法是使用pH试纸;中性溶液或酸性溶液都不能使酚酞试液变色所以最后所得溶液的pH值可能小于7,也可能等于7;
故填:红色逐渐变浅直至褪去;左;pH试纸;<.
【评价反思】由于氢氧化钠固体溶于水会放出热量,到底热量是氢氧化钠与盐酸反应放出的,还是氢氧化钠固体溶于水放出的,无法判断,所以乙同学的实验现象不能说明氢氧化钠与盐酸发生了反应,故填:乙;氢氧化钠固体溶于水也会放出热量;
【拓展应用】:①根据曲线可以看出,加入氢氧化钠溶液的质量为20g时二者恰好完全反应,所以本题答案为:20g;
②根据曲线可以看出,加入氢氧化钠溶液的质量为20g时二者恰好完全反应,而15g氢氧化钠溶液时有剩余的盐酸.故答案为:HCl;
③设稀盐酸中溶质质量为x
NaOH+HCl═NaCl+H2O
40 36.5
20g×8% x
$\frac{40}{20g×8%}$=$\frac{36.5}{x}$,x=1.46g
盐酸的质量分数$\frac{1.46g}{20g}$×100%=7.3%
答:稀盐酸的溶质质量分数为7.3%.
点评 本题是已设计的实验方案进行评价,以及自己设计实验方案的题目,要注意考虑所涉及物质的化学性质,据它们的化学性质来设计方案,这是我们解题的大方向.

| A. | 五味子甲素中碳氢氧元素的质量比为12:61:3 | |
| B. | 相对分子质量为416 | |
| C. | 保持五味子甲素的化学性质的微粒为C、H、O | |
| D. | 五味子甲素中氢元素的质量分数最高 |
[提出问题]醋酸能与哪些不同类别的物质反应呢?
[猜想]
①活泼金属;
②碳酸盐;
③碱.(填物质类别不要填具体物质)
[设计实验]请你选用家中能找到的物质验证你的一种猜想.
| 实验步骤 | 实验现象 | 结论 |
[继续探究]根据生活经验,有关白醋(酸的通性除外)你还想探究什么问题?做鱼时为什么要放白醋?.
提出假设:活性炭的吸附效果和活性炭的量有关
完成实验:按下表进行实验,取容积相同的集气瓶(125mL),收集满红棕色的二氧化氮气体,并进行编号,记录颜色消失的时间.
| 实验编号 | 活性炭纯度 | 活性炭的用量(克) | 消失时间(秒) |
| 1 | 80% | 1.0 | 60 |
| 2 | 9.0 | 45 |
要完成本实验,实验标号2中活性炭的纯度应该为80%
(1)该探究过程得出的结论是:相同条件下,活性炭量越多,吸附效果越好
(2)反思:(1)某品牌冰箱的除味剂主要成分是活性炭,其说明书中写到“切勿靠近高温”,原因是活性炭具有(用化学方程式表示):C+O2$\frac{\underline{\;高温\;}}{\;}$CO2
(2)活性炭的吸附效果还和那些因素有关?请你帮他们继续探究(只要求提出假设和实验方案).
假设:活性炭的吸附效果和表面积有关
实验方案:取相同质量的活性炭两份,1份颗粒较大,1份颗粒较小,分别放入容积相同的收集满红棕色的二氧化氮气体的集气瓶中,观察红棕色消失的时间.
(1)探究稀硫酸和氢氧化钠溶液的反应:

①A烧杯当滴入几滴酚酞试液后,溶液由无色变为红色.
②根据上述实验中颜色变化,确定稀硫酸与氢氧化钠溶液发生了化学反应.随着稀硫酸滴入,烧杯溶液中减少的离子是氢氧根离子,增加的离子是硫酸根离子.
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量.同学们又分别选取氯化钡溶液与紫色石蕊试液设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
④另外一个实验方案错误的原因是(文字表述)NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4;
⑤请再设计一个实验方案确定稀硫酸过量,你会选用锌粒(或碳酸钠等)(药品)来实验.
| A. | 无色无味 | B. | 难溶于水 | ||
| C. | 氢气是最轻的气体 | D. | 能够燃烧 |
【发现问题】:可燃物燃烧的剧烈程度与哪些因素有关呢?
【提出猜想】:
猜想①:燃烧的剧烈程度可能与氧气的接触面积有关;
猜想②:燃烧的剧烈程度可能与氧气的浓度有关.
【验证猜想】:实验报告如下:
| 验证猜想 | 实验操作 | 实验现象 | 实验结论 |
| 猜想① | 取两张相同的纸,其中一张卷成纸团,点燃 | 卷成纸团的纸燃烧不如没有卷成纸团的纸燃烧剧烈 | 与氧气接触面积大的纸燃烧更剧烈 |
| 猜想② | 点燃相同的两份红磷,其中一份放入盛有氧气的集气瓶中 | 放入盛有氧气的集气瓶中的红磷燃烧比空气中的红磷燃烧更剧烈 | 氧气浓度大的红磷燃烧更剧烈 |
 如图是a、b、c三种物质的溶解度曲线.
如图是a、b、c三种物质的溶解度曲线.