题目内容
 甲为初中化学常见物质,请根据下列叙述回答问题.
甲为初中化学常见物质,请根据下列叙述回答问题.(1)若甲可以用于灭火,将甲通入紫色石蕊试液中,观察到试液变红色,发生反应的化学方程式为
(2)若甲是一种红色固体氧化物,将甲放入过量的稀盐酸中,观察到固体消失,
(3)若甲含有4种元素且能与稀盐酸反应产生气泡.向甲的溶液中加入过量氢氧化钠溶液,发生反应生成乙和水,但无明显现象;向反应后的溶液中逐滴滴加稀盐酸,一段时间后产生气泡.甲与氢氧化钠溶液的反应方程式为
(4)若一定量的甲与乙在一定条件下发生反应,下列情况与图象的对应关系正确的是
| 甲 | 乙 | y轴含义 | |
| A | 生石灰 | 水 | 固体质量 |
| B | 铜锌合金粉末 | 硫酸铜溶液 | 溶液质量 |
| C | 工业炼铁的尾气 | 氢氧化钠溶液 | 气体质量 |
| D | 密闭容器中的空气 | 红磷 | 反应过程中容器内压强 |
考点:物质的鉴别、推断,空气组成的测定,金属的化学性质,生石灰的性质与用途,酸的化学性质,碱的化学性质
专题:常见物质的推断题,元素化合物知识型
分析:根据题干题干的信息进行分析,甲通入紫色石蕊试液中,观察到试液变红色,则甲是二氧化碳,能与水反应生成碳酸;甲是一种红色固体氧化物,则甲是氧化铁,能与盐酸反应生成氯化铁和水,氯化铁的水溶液呈黄色;甲含有4种元素且能与稀盐酸反应产生气泡,则甲是碳酸氢钠;根据物质间的反应与图象的关系进行分析解答即可.
解答:解:(1)甲通入紫色石蕊试液中,观察到试液变红色,则甲是二氧化碳,能与水反应生成碳酸,故填:CO2+H2O=H2CO3;
(2)甲是一种红色固体氧化物,则甲是氧化铁,能与盐酸反应生成氯化铁和水,氯化铁的水溶液呈黄色,由于盐酸过量,一定含有氯化氢,故填:无色溶液变为黄色,FeCl3、HCl;
(3)甲含有4种元素且能与稀盐酸反应产生气泡,则甲是碳酸氢钠,碳酸氢钠能与氢氧化钠反应生成碳酸钠和水,故填:NaHCO3+NaOH=Na2CO3+H2O;
(4)A、生石灰与水反应生成氢氧化钙,固体质量逐渐增加,当氧化钙反应完全,固体质量不变,错误;
B、锌于硫酸铜反应生成硫酸锌和铜,由于参加反应的金属锌的质量大于被置换出的铜的质量,故溶液的质量增大,直至锌全部参加反应不再改变,错误;
C、工业炼铁的尾气中含有二氧化碳,被氢氧化钠吸收,则气体质量减小,直至二氧化碳被吸收尽,气体质量不再改变,正确;
D、在密闭容器内燃烧红磷,放出大量的热,开始压强增大,产生的是固体,消耗了氧气,导致装置内的压强逐渐变小,当氧气消耗尽,压强不再改变,错误;
故填:C.
(2)甲是一种红色固体氧化物,则甲是氧化铁,能与盐酸反应生成氯化铁和水,氯化铁的水溶液呈黄色,由于盐酸过量,一定含有氯化氢,故填:无色溶液变为黄色,FeCl3、HCl;
(3)甲含有4种元素且能与稀盐酸反应产生气泡,则甲是碳酸氢钠,碳酸氢钠能与氢氧化钠反应生成碳酸钠和水,故填:NaHCO3+NaOH=Na2CO3+H2O;
(4)A、生石灰与水反应生成氢氧化钙,固体质量逐渐增加,当氧化钙反应完全,固体质量不变,错误;
B、锌于硫酸铜反应生成硫酸锌和铜,由于参加反应的金属锌的质量大于被置换出的铜的质量,故溶液的质量增大,直至锌全部参加反应不再改变,错误;
C、工业炼铁的尾气中含有二氧化碳,被氢氧化钠吸收,则气体质量减小,直至二氧化碳被吸收尽,气体质量不再改变,正确;
D、在密闭容器内燃烧红磷,放出大量的热,开始压强增大,产生的是固体,消耗了氧气,导致装置内的压强逐渐变小,当氧气消耗尽,压强不再改变,错误;
故填:C.
点评:本题为框图式物质推断题,完成此题,关键是依据题干叙述找准解题的突破口,然后推导出其他物质的化学式.

练习册系列答案
相关题目
每年5月31日为世界无烟日,吸烟有害健康,烟气中一定含有的有毒气体是( )
| A、O2 |
| B、N2 |
| C、CO2 |
| D、CO |
工业尾气硫化氢(H2S)是一种有毒气体,溶于水成为氢硫酸(H2S)溶液.目前采用氢氧化钠溶液吸收可以减少对空气的污染,并且可以制得工业产品硫化钠固体(硫化钠可溶于水).工业流程如图所示.则下列说法正确的是( )
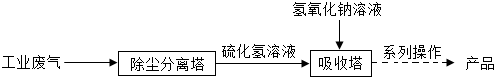

| A、终产品硫化钠的化学式为Na2SO4 |
| B、可用石蕊溶液测定氢硫酸溶液的酸碱度 |
| C、系列操作中含有蒸发这一操作 |
| D、吸收塔内发生的反应基本类型是中和反应 |
 活动与探究课上,某实验小组的同学对失去标签的①稀盐酸②氢氧化钠③碳酸钠④氢氧化钙四瓶溶液进行鉴别时,他们按照讨论的方案,分别取四种溶液各少量进行两两混合的实验.
活动与探究课上,某实验小组的同学对失去标签的①稀盐酸②氢氧化钠③碳酸钠④氢氧化钙四瓶溶液进行鉴别时,他们按照讨论的方案,分别取四种溶液各少量进行两两混合的实验. 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.