题目内容
19.如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分装置(组装实验装置时,可重复选择).试根据题目要求,回答下列问题: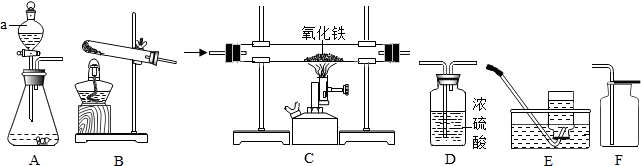
Ⅰ、氯酸钾固体和二氧化锰混合加热,能较快的产生氧气.小刚同学欲在实验室中以此方法制备并收集干燥的氧气.
(1)所选装置的连接顺序为BDF(填写仪器序号字母).
(2)用氯酸钾制备氧气的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
Ⅱ、小强同学欲用锌和稀硫酸反应制取氢气,然后利用氢气测定某氧化铁样品中含Fe2O3的质量分数(假设杂质不发生反应).选择制取氢气的发生装置是A,接下来连接装置的顺序为:D1→C→D2→D3.(已知:Fe2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O;其中D1、D2、D3为三个盛浓硫酸的洗气瓶)
(1)写出仪器a的名称分液漏斗.在装药品之前,检查装置A气密性的具体操作是关闭活塞,将右侧导气管通入水中,用手握住锥形瓶,观察导管口有无气泡产生.
(2)小强欲通过测量反应前后D2浓硫酸洗气瓶的质量变化,测算氧化铁样品中含有Fe2O3的质量分数.实验中,在其他操作正常的条件下,若装置中不连接D1,则测算结果将偏大(填写“偏小”、“偏大”或“不受影响”).
分析 分液漏斗可以控制反应的速度,制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集.在装药品之前,检查装置A气密性的具体操作是:关闭活塞,将右侧导气管通入水中,用手握住锥形瓶,观察导管口有无气泡产生;小强欲通过测量反应前后D2浓硫酸洗气瓶的质量变化,测算氧化铁样品中含有Fe2O3的质量分数.实验中,在其他操作正常的条件下,若装置中不连接D1,则测算结果将偏大,因为会增加水的质量.
解答 Ⅰ(1)如果用氯酸钾和二氧化锰制氧气就需要加热,氧气可以用浓硫酸干燥,用向上排空气法收集的氧气比较干燥;故答案为:BDF
(2)氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
Ⅱ验室是用锌粒和稀硫酸在常温下反应制氢气的,因此不需要加热;故答案为:A
(1)分液漏斗可以控制反应的速度,在装药品之前,检查装置A气密性的具体操作是:关闭活塞,将右侧导气管通入水中,用手握住锥形瓶,观察导管口有无气泡产生;故答案为:分液漏斗;关闭活塞,将右侧导气管通入水中,用手握住锥形瓶,观察导管口有无气泡产生(合理答案即可)
(2)实验中,在其他操作正常的条件下,若装置中不连接D1,则测算结果将偏大,因为会增加水的质量;故答案为:偏大
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、检查装置的气密性等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 名校课堂系列答案
名校课堂系列答案| A. | 用肥皂水区别硬水和软水 | B. | 用水区别CaCO3和NaCl | ||
| C. | 用酚酞试液区别盐酸和食盐水 | D. | 用灼烧的方法区分羊毛和涤纶 |
 如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )
如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )| A. | 物质C具有助燃性 | B. | 物质G的浓溶液一定具有挥发性 | ||
| C. | E→F的反应可能会产生大量气泡 | D. | H─G的反应为复分解反应 |
【提供资料】①二氧化碳与过氧化钠反应生成氧气和另一种物质.
②Na2O2是一种淡黄色固体,常温下能与H2O、HCl气体等物质发生反应,生成氧气不能与N2发生反应.
(1)探究二氧化碳与过氧化钠反应生成氧气.
同学们在老师的指导下设计了如图所示装置.

①写出检验G中气体的方法将带火星木条伸入集气瓶中,若木条复燃,证明气体为氧气.
②若无装置C,对实验有影响的物质是H2O.
③若观察到装置F不变浑浊,说明二氧化碳已经除尽.
(2)探究二氧化碳与过氧化钠反应生成的另一种物质.
【猜想与假设】下面是同学们提出的3种猜想.
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
你认为猜想1、2是不正确的,理由是参加反应的物质中不含氢元素,不可能生成氢氧化钠或碳酸氢钠.
【进行实验】排除错误猜想后,同学们通过以下实验验证了另一种物质.
| 实验操作 | 实验现象 |
| 取少量CO2与Na2O2反应后的固体于试管中,加入稀盐酸. | 有大量气泡产生 |
①某同学认为上述方案存在不足,他的理由是二氧化碳与过氧化钠反应后的固体中可能含有未反应完的过氧化钠,与盐酸反应也会有气泡产生,不能证明固体中有碳酸钠.
②写出过氧化钠与二氧化碳反应的化学方程式2CO2+2Na2O2=O2+2Na2CO3.
| A.化学与安全 | B.化学与生活 |
| 稀酸溅入眼--用大量水冲洗 室内着火--不急于打开门窗 | 铅笔芯粉末放入锁芯--开锁更灵活 油肪虽使人肥胖--进食时也要适量摄入脂肪 |
| C.化学与材料 | D.化学与符号 |
| 不锈钢汤勺--合金 所有的橡胶--有机合成材料 | Fe2+--可表示一个亚铁离子 CO2--可以表示二氧化碳这种物质 |
| A. | A | B. | B | C. | C | D. | D |
 在哈尔滨市继今年1月份5台纯电动公交车上道试运营后,近日两台插电式气电混合动力公交车也在公交8路、107路上线试运营.插电式混合动力公交车车速23公里/小时以下,为纯电力驱动;速度超过23公里/小时,为气电混合驱动.按照测算,与常规天然气公交车相比,氮氧化物排放量可减少76%、二氧化碳排放量可减少60%,PM排放量可减少86%.回答下列问题.
在哈尔滨市继今年1月份5台纯电动公交车上道试运营后,近日两台插电式气电混合动力公交车也在公交8路、107路上线试运营.插电式混合动力公交车车速23公里/小时以下,为纯电力驱动;速度超过23公里/小时,为气电混合驱动.按照测算,与常规天然气公交车相比,氮氧化物排放量可减少76%、二氧化碳排放量可减少60%,PM排放量可减少86%.回答下列问题.
