题目内容
9. 如图是A、B的溶解度曲线.某同学要配制甲、乙两种物质的饱和溶液,而且溶质的质量分数相同,他应该将温度控制在t1℃;把t2℃时150gA的饱和溶液稀释为20%,需加水100 g.
如图是A、B的溶解度曲线.某同学要配制甲、乙两种物质的饱和溶液,而且溶质的质量分数相同,他应该将温度控制在t1℃;把t2℃时150gA的饱和溶液稀释为20%,需加水100 g.
分析 根据物质的溶解度曲线可以判断一定质量的溶质的溶质溶解在一定质量的溶剂中形成的溶液中溶质的质量分数;
饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%;根据溶液稀释时溶质的质量不变,分析计算加入水的质量.
解答 解:要配制甲、乙两种物质的饱和溶液,而且溶质的质量分数相同,那么应该将温度控制在t120℃,因为该温度时两种物质的溶解度相等,配制的饱和溶液中溶质的质量分数相同.
在t2℃,A的溶解度是50g,设需要加水的质量为x,150g×$\frac{50g}{100g+50g}$=(150g+x)×20%
解得:x=100g.
答案:t1;100.
点评 本题主要考查了固体溶解度曲线的意义及固体溶解度和温度间的关系,并能利用所学知识来解决实际问题.

练习册系列答案
相关题目
19.如图是几种粒子的结构示意图,有关说法正确的是( )


| A. | ③和④属于同种元素 | B. | ③表示阴离子 | ||
| C. | ①属于金属元素 | D. | ②属于稀有气体元素 |
20.同学们在实验室用混合两种固体药品的办法自制“钾、氮复合肥”,使用到的药品有KCl,K2SO4,NH4HCO3,NH4Cl.同学们制得了成分不同的“钾、氮复合肥”,从中抽取一份作为样品探究其成分,请回答有关问题:限选试剂:稀盐酸,稀硫酸,BaCl2溶液,AgNO3溶液,蒸馏水
(1)提出合理假设.所抽样品的成分共有4种可能:
假设1:KCl和NH4HCO3;
假设2:KCl和NH4Cl;
假设3:K2SO4和NH4HCO3;
假设4:K2SO4和NH4Cl.
(2)形成设计思路.
①甲同学提出先用AgNO3溶液确定是否含有KCl,你是否同意?其理由是什么?不同意,因为氯化铵和硝酸银反应也能够生成白色沉淀氯化银.
②乙同学提出先确定是否含有NH4HCO3,则可以选择的试剂是稀盐酸或稀硫酸.
(3)【完成实验方案】请填写实验操作及与表中结论相符的预期现象.
(1)提出合理假设.所抽样品的成分共有4种可能:
假设1:KCl和NH4HCO3;
假设2:KCl和NH4Cl;
假设3:K2SO4和NH4HCO3;
假设4:K2SO4和NH4Cl.
(2)形成设计思路.
①甲同学提出先用AgNO3溶液确定是否含有KCl,你是否同意?其理由是什么?不同意,因为氯化铵和硝酸银反应也能够生成白色沉淀氯化银.
②乙同学提出先确定是否含有NH4HCO3,则可以选择的试剂是稀盐酸或稀硫酸.
(3)【完成实验方案】请填写实验操作及与表中结论相符的预期现象.
| 实验操作 | 预期现象 | 结论 |
| 步骤1:取少量固体于试管中,滴加适量的稀盐酸或稀硫酸 | 不产生气泡 | 假设2成立 |
| 步骤2:另取少量固体于另一支试管中,加足量的水溶解,滴加适量的氯化钡溶液 | 不产生白色沉淀 |
17.如图是某个化学反应前后的微观模拟图,通过对该图的分析,下列说法正确的是( )
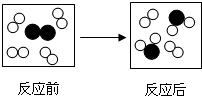

| A. | 该反应中元素的化合价不变 | |
| B. | 在该化学反应中,分子可分,原子不可分 | |
| C. | 参加反应的物质分子个数比为1:4或4:1 | |
| D. | 该反应时置换反应 |
14.如表为氯化钠和氯化铵在不同温度时的溶解度,回答下列问题:
(1)由表中数据可知,溶解度受温度影响变化较大的物质是NH4Cl.
(2)20℃时lO0g水最多只能溶解NaCl36.0g,氯化钠与氯化铵溶解度相等的温度范围在10~20之间.
(3)向烧杯中加入100g水和50.0g氯化铵配成50℃的溶液,再冷却到20℃,烧杯中析出固体12.8g.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
| NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(2)20℃时lO0g水最多只能溶解NaCl36.0g,氯化钠与氯化铵溶解度相等的温度范围在10~20之间.
(3)向烧杯中加入100g水和50.0g氯化铵配成50℃的溶液,再冷却到20℃,烧杯中析出固体12.8g.
1.某同学的如下几种操作,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
19.为了验证金属的活动性,同学们将洁净的铁钉放入硫酸铜溶液中,观察到铁钉表面变为红色,反应的化学方程式为Fe+CuSO4═FeSO4+Cu;.细心的同学发现,铁钉表面同时含有气泡冒出,就此气泡成分,同学们在老师指导下进行了如下探究:
【提出猜想】
同学们一致认为C同学的猜想是不合理的,理由是根据质量守恒定律,化学反应前后元素种类不变,反应物中没有碳元素所以生成物中一定没有二氧化碳.
【查阅资料】二氧化硫具有漂白性,会使品红溶液褪色.
【进行实验】利用如图所示的装置分别进行实验

(1)反应一段时间后,A同学将带火星的木条放在a处,观察到带火星的木条没有复燃,则她的猜想错误.
(2)B同学将产生的气体通入品红溶液中,观察到品红溶液不褪色,则她的猜想也错误.
(3)D同学将图Ⅰ中的a端导管与图Ⅱ中的c端导管相连,目的是对其他进行干燥.反应一段时间后,点燃从图Ⅱ另一端导管出来的气体,通过对现象的分析,得出他的猜想正确.
【得出结论】铁与硫酸铜溶液反应时伴随产生了氢气.
【讨论反思】这几位同学的实验方案存在安全隐患,理由是该实验中氢气属于可燃性气体,不纯点燃可能会发生爆炸,改进的方法是先将从a处的气体通入图Ⅱ一段时间后再点燃.
【继续追问】铁与硫酸铜溶液反应为什么会伴随产生氢气?
【查阅资料】有些盐在水溶液中会发生水解反应,使盐溶液不一定呈中性.
【再次猜想】硫酸铜溶液可能显酸性.
【验证方案】
【反思与评价】同学们做完以上实验很有成就感,体验到探究的快乐,并感慨“科学探究无止境”!
【提出猜想】
| 同学 | A | B | C | D |
| 对气泡成分的猜想 | 氧气 | 二氧化硫 | 二氧化碳 | 氢气 |
【查阅资料】二氧化硫具有漂白性,会使品红溶液褪色.
【进行实验】利用如图所示的装置分别进行实验

(1)反应一段时间后,A同学将带火星的木条放在a处,观察到带火星的木条没有复燃,则她的猜想错误.
(2)B同学将产生的气体通入品红溶液中,观察到品红溶液不褪色,则她的猜想也错误.
(3)D同学将图Ⅰ中的a端导管与图Ⅱ中的c端导管相连,目的是对其他进行干燥.反应一段时间后,点燃从图Ⅱ另一端导管出来的气体,通过对现象的分析,得出他的猜想正确.
【得出结论】铁与硫酸铜溶液反应时伴随产生了氢气.
【讨论反思】这几位同学的实验方案存在安全隐患,理由是该实验中氢气属于可燃性气体,不纯点燃可能会发生爆炸,改进的方法是先将从a处的气体通入图Ⅱ一段时间后再点燃.
【继续追问】铁与硫酸铜溶液反应为什么会伴随产生氢气?
【查阅资料】有些盐在水溶液中会发生水解反应,使盐溶液不一定呈中性.
【再次猜想】硫酸铜溶液可能显酸性.
【验证方案】
| 操作 | 现象 | 结论 |
| 向硫酸铜溶液中滴加石蕊试液 | 溶液变红 | [再次猜想]是正确的. |
