题目内容
18.牙膏摩擦剂的类型很多,如CaCO3、SiO2或它们的混合物.某兴趣小组对某品牌牙膏摩擦剂的成分进行了如下探究.【提出问题1】某品牌牙膏中是否含有CaCO3?
【查阅资料】二氧化硅不与稀盐酸反应;碱石灰主要成分为生石灰与氢氧化钠.
【实验方案】取少量牙膏于试管中,加入适量的稀盐酸,出现气泡,将气体通入澄清石灰水,石灰水变浑浊,证明摩擦剂中含有CO32-(填离子符号);石灰水变浑浊的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O.
【提出问题2】该牙膏中CaCO3的质量分数是多少?
【实验装置】

(1)连接好装置后,首先进行的操作是检查装置的气密性.
(2)在B装置中加入牙膏样品5g;
(3)关闭K1,打开K2(填“打开”或“关闭”),向牙膏样品中滴入10%的盐酸,至B中无气泡产生时,停止滴加盐酸;
(4)打开K1,关闭K2,缓缓鼓入空气,至C中不再产生沉淀.
(5)将C装置中的固液混合物过滤、洗涤、烘干后称量其质量为1.97g.(已知此品牌牙膏中的其他成分不和盐酸反应,装置内试剂均足量且充分反应.)
【实验分析及数据处理】
(1)若没有A装置,则实验测定结果将偏大.(填“偏大”、“偏小”或“不变”)
(2)D装置的作用是防止空气中的二氧化碳进入装置C中.
(3)根据上面数据计算,牙膏样品中碳酸钙的质量分数是20%.
分析 【实验方案】碳酸钙能够稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳能使澄清石灰水变浑浊;
【实验步骤】凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
二氧化碳能和氢氧化钡反应生成白色沉淀碳酸钡和水;
氢氧化钠溶液能够吸收空气中的二氧化碳;
碱石灰能够吸收水和二氧化碳.
解答 解:【实验方案】
将气体通入澄清石灰水,石灰水变浑浊,说明该气体是二氧化碳,证明摩擦剂中含有碳酸钙,碳酸钙中含有碳酸根离子,碳酸根离子可以表示为CO32-;
二氧化碳能使澄清的石灰水变浑浊,是因为二氧化碳和石灰水中的氢氧化钙反应生成了碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
【提出问题2】该牙膏中CaCO3的质量分数是多少?
【实验步骤】
(1)连接好装置,首先进行的操作是检查装置的气密性;
(3)关闭K1,打开K2,然后向牙膏样品中滴入质量分数为10%的盐酸,至B中无气泡产生时,停止滴加盐酸;
(4)打开K1,关闭K2,缓缓鼓入空气,至C中不再产生沉淀;
【实验分析及数据处理】
(1)若没有A装置,则空气中的二氧化碳能够被氢氧化钡溶液吸收,从而导致测定结果偏大;
(2)D装置的作用是防止空气中的二氧化碳进入装置C中;
(3)设碳酸钙的质量为x,
由CaCO3+2HCl═CaCl2+H2O+CO2↑,Ba(OH)2+CO2═BaCO3↓+H2O可知,CaCO3~BaCO3↓,
CaCO3~BaCO3↓,
100 197
x 1.97g
$\frac{100}{x}=\frac{197}{1.97g}$
x=1g,
牙膏样品中碳酸钙的质量分数为:$\frac{1g}{5g}×$100%=20%
故答案为:
【实验方案】CO32-;Ca(OH)2+CO2=CaCO3↓+H2O;
【实验装置】
(2)检查装置的气密性;
(3)关闭;打开;
(4)不再产生沉淀;
【实验分析及数据处理】
(1)偏大;
(2)防止空气中的二氧化碳进入装置C中;
(3)20%.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | 过量摄入油脂会使人发胖,应禁止食用油脂 | |
| B. | 海鲜产品从沿海运到衡阳过程中可以喷洒甲醛溶液防腐 | |
| C. | 在煲好的鸡汤中放入适量的加碘食盐 | |
| D. | 为了保持香肠肉质鲜美,添加过量的亚硝酸钠 |

下列判断正确的是( )
| A. | 蓝色溶液B中阳离子只有Cu2+ | |
| B. | 无色溶液A中一定有NaOH | |
| C. | 原固体粉末一定有NaCl | |
| D. | 原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2 |
(1)分类是学习化学的重要方法之一.
①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同)D,属于氧化物的是C.
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是B.
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
(2)实验是学习化学的一条重要途径,实验室中可用KClO3在MnO2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO2难溶于水)

①图A中试管口略向下倾斜的原因是防止水倒流,炸裂试管,图B操作中玻璃棒的作用是搅拌,加速溶解.
②图C操作中的一处明显错误是漏斗末端没有紧靠烧杯内壁,图D操作中,当看到有较多固体析出时,停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论.
①下列表述正确的是B
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O2完全反应后,生成64g SO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如下表:
| R | O2 | CO2 | H2O | |
| 反应前质量/g | 46 | 128 | 0 | 0 |
| 反应后质量/g | 0 | 32 | x | 54 |
| A. | 长期放置后不会分层的液体一定是溶液 | |
| B. | 在沉淀、吸附、过滤、消毒、蒸馏等净水过程中,消毒净化程度最高 | |
| C. | 稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢注入水里,并不断搅拌 | |
| D. | 人体摄入锌不足会引起多种疾病,所以应该大量服用补锌的保健品 |
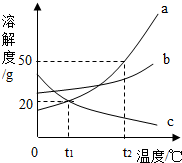 如图是三种物质的溶解度曲线,下列说法正确的是( )
如图是三种物质的溶解度曲线,下列说法正确的是( )| A. | 物质c的溶解度随温度的升高而增大 | |
| B. | 物质a的溶解度大于物质c的溶解度 | |
| C. | t2℃时,60g物质a与100g水充分混合后所得溶液的总质量为160g | |
| D. | 将t1℃b、c两种物质的饱和溶液升温至t2℃,溶液中溶质质量分数不变的是b溶液 |
 如图是A、B的溶解度曲线.某同学要配制甲、乙两种物质的饱和溶液,而且溶质的质量分数相同,他应该将温度控制在t1℃;把t2℃时150gA的饱和溶液稀释为20%,需加水100 g.
如图是A、B的溶解度曲线.某同学要配制甲、乙两种物质的饱和溶液,而且溶质的质量分数相同,他应该将温度控制在t1℃;把t2℃时150gA的饱和溶液稀释为20%,需加水100 g. 如图是X、Y、Z三种固体物质的溶解度曲线图,根据曲线图回答下列问题.
如图是X、Y、Z三种固体物质的溶解度曲线图,根据曲线图回答下列问题.