题目内容
5.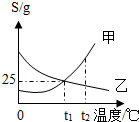 如图为甲、乙两种固体的溶解度曲线,下列说法正确的是( )
如图为甲、乙两种固体的溶解度曲线,下列说法正确的是( )| A. | 甲、乙溶解度均随温度升高而增大 | |
| B. | 降温或蒸发均可使乙物质从其饱和溶液中结晶析出 | |
| C. | 甲、乙饱和溶液从t1升温之t2时,其浓度均保持不变 | |
| D. | t1时,甲、乙饱和溶液中溶质和溶剂的质量比均为1:4 |
分析 根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
根据溶解度曲线可以判断温度、溶剂变化时是否析出晶体;
溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%;
根据物质的溶解度曲线可以判断t1时,甲、乙饱和溶液中溶质和溶剂的质量比.
解答 解:A、甲的溶解度随温度升高而增大,乙的溶解度随着温度升高而减小,该选项说法不正确;
B、降温不能使乙析出晶体,蒸发可使乙物质从其饱和溶液中结晶析出,该选项说法不正确;
C、甲、乙饱和溶液从t1升温之t2时,甲变成不饱和溶液,其浓度不变,而乙仍然是饱和溶液,但是析出晶体,浓度减小,该选项说法不正确;
D、t1时,甲、乙的溶解度相等,都是25g,饱和溶液中溶质和溶剂的质量比均为:25g:100g=1:4,该选项说法正确.
故选:D.
点评 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.

练习册系列答案
相关题目
18.下列日常生活中常发生的一些变化,属于化学变化的是( )
| A. | 水蒸发 | B. | 灯泡发光 | C. | 蔗糖溶解 | D. | 铁生锈 |
19.请根据你对课本实验的观察,填写下表
回答下列问题:
(1)实验①②的共同特征没有生成新物质;只有物质的状态、形状等的变化,属于物理变化;
(2)实验③④的共同特征:变化时生成新物质属于化学变化.
| 实验 | 变化时发生的现象 | 变化后有无新物质生成 | |
| ① | 给水加热 | 液态水沸腾,产生水蒸气,水蒸气遇冷的玻璃片又凝结为水 | 没有生成新物质 |
| ② | 胆矾研碎 | 蓝色块状固体研碎后成为粉末状固体 | 没有生成新物质 |
| ③ | 胆矾溶液+氢氧化钠溶液 | 生成蓝色沉淀,溶液颜色变浅,最后成为无色 | 有新物质生成 |
| ④ | 石灰石+稀盐酸 | 石灰石表面有气泡产生,石灰石渐渐减少,澄清石灰水变浑浊 | 有新物质生成 |
(1)实验①②的共同特征没有生成新物质;只有物质的状态、形状等的变化,属于物理变化;
(2)实验③④的共同特征:变化时生成新物质属于化学变化.
13.下列实验操作中错误的是( )
| A. |  蒸发结晶 | B. |  检查气密性 检查气密性 | ||
| C. |  试管用后不清洗直接插入液体 | D. |  塞紧橡皮塞 |
20.下列有关实验操作、现象或结论的描述正确的是( )
| A. | 向蛋清溶液中加入饱和的硫酸铵溶液,产生白色沉淀为化学变化 | |
| B. | 氢氧化钠固体不能放在纸上称量,也不能直接放在天平的托盘上称量,可放在烧杯中称量 | |
| C. | 稀释浓硫酸的方法,将水沿烧杯壁慢慢倒入盛有浓硫酸的烧杯中,并用玻璃棒不断搅拌 | |
| D. | 用湿润的蓝色石蕊试纸检验氨气时,试纸变为红色 |
10.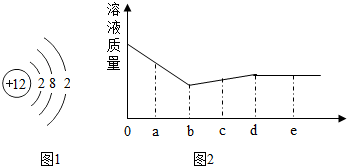 某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.
某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.
(1)图1是镁原子的结构示意图.下列说法不正确的是AD.
A 镁原子的核外电子数为2
B 在化合物中镁通常显+2价
C 镁在空气中燃烧发出耀眼白光
D 镁是地壳中含量最多的金属元素
(2)铝制品比较耐腐蚀,其原因是铝和氧气反应生成一层致密的氧化铝薄膜,对自身起到了保护作用.相同铁制品在沿海地区比在沙漠地区生锈更快的原因是沿海地区比沙漠地区空气潮湿,铁在潮湿的空气中易生锈.
(3)向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,充分反应,所得溶液质量与加入锌的质量关系如图2所示.
①当锌的质量为ag时,溶液中一定含有的溶质有Zn(NO3)2、AgNO3、Cu(NO3)2(填“化学式”).
②当锌的质量为bg时,溶液呈蓝色.
③当锌的质量为eg时,过滤得到固体,可通过以下实验探究固体的成分,请将下表填写完整.
④实验室用锌和酸反应可以制取氢气,金属钠可以与氢气发生反应,反应的化学方程式为:H2+2Na$\frac{\underline{\;\;△\;\;}}{\;}$2NaH,以实现氢气的储存.请计算若用230g金属钠吸收氢气,理论上需要金属锌的质量是多少?
 某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.
某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.(1)图1是镁原子的结构示意图.下列说法不正确的是AD.
A 镁原子的核外电子数为2
B 在化合物中镁通常显+2价
C 镁在空气中燃烧发出耀眼白光
D 镁是地壳中含量最多的金属元素
(2)铝制品比较耐腐蚀,其原因是铝和氧气反应生成一层致密的氧化铝薄膜,对自身起到了保护作用.相同铁制品在沿海地区比在沙漠地区生锈更快的原因是沿海地区比沙漠地区空气潮湿,铁在潮湿的空气中易生锈.
(3)向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,充分反应,所得溶液质量与加入锌的质量关系如图2所示.
①当锌的质量为ag时,溶液中一定含有的溶质有Zn(NO3)2、AgNO3、Cu(NO3)2(填“化学式”).
②当锌的质量为bg时,溶液呈蓝色.
③当锌的质量为eg时,过滤得到固体,可通过以下实验探究固体的成分,请将下表填写完整.
| 实验步骤 | 现象 | 化学方程式 |
| 取少量固体样品,加稀盐酸 | 有无色气味气体生成 | Zn+2HCl=ZnCl2+H2↑ |
17.在世界范围内,污染空气的主要气体是( )
| A. | 氮气、二氧化硫、二氧化氮 | B. | 二氧化碳、二氧化硫、二氧化氮 | ||
| C. | 水蒸气、二氧化硫、二氧化氮 | D. | 一氧化碳、二氧化硫、二氧化氮 |
14.下列过程中发生化学变化的是( )
| A. | 石墨导电 | B. | 将石墨转化成金刚石 | ||
| C. | 干冰升华成二氧化碳气体 | D. | 金刚石切割大理石 |
15.下列各组溶液,不加其他试剂就不能鉴别的是( )
| A. | BaCl2、Na2SO4、K2CO3、HNO3 | B. | NaOH、NaCl、石蕊、稀HCl | ||
| C. | AgNO3、NaCl、CaCl2、HNO3 | D. | CuSO4、NaCl、KOH、HCl |