题目内容
5.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展.其流程简图和部分物质的溶解度曲线如下: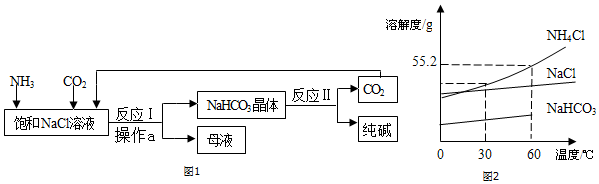
已知:①母液中有一种铵态氮肥
②NH3在水中的溶解能力远远大于CO2
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
请回答下列问题:
(1)操作a的名称是过滤,NaCl饱和溶液中大量存在的阳离子的符号为Na+;
(2)要向NaCl饱和溶液中先通入NH3(选填:“NH3”或“CO2”),其原因是使溶液呈碱性,促进CO2的吸收,更多地析出沉淀;
(3)反应Ⅰ的方程式为NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl;
(4)流程中得到的母液中一定含有的溶质是NaHCO3、NH4Cl;流程中可以循环使用的物质是CO2;
(5)从图中可以看出温度高于60℃,NaHCO3的溶解度曲线“消失”了,其原因可能温度高于60℃时碳酸氢钠开始分解.
分析 (1)操作a的名称是过滤,通过过滤可以把液体和固体分离;
NaCl饱和溶液中大量存在的阳离子是钠离子;
(2)要向NaCl饱和溶液中先通入NH3,其原因是显碱性的溶液更容易吸收二氧化碳;
(3)反应Ⅰ中,氯化钠和水、氨气、二氧化碳反应生成碳酸氢钠和氯化铵;
(4)流程中得到的母液中一定含有碳酸氢钠和氯化铵,流程中可以循环使用的物质是二氧化碳;
(5)从图中可以看出温度高于60℃,NaHCO3的溶解度曲线“消失”了,其原因可能碳酸氢钠在该温度下开始分解生成碳酸钠、水和二氧化碳.
解答 解:(1)操作a的名称是过滤,NaCl饱和溶液中大量存在的阳离子的符号为Na+.
故填:过滤;Na+.
(2)要向NaCl饱和溶液中先通入NH3,其原因是使溶液呈碱性,促进CO2的吸收,更多地析出沉淀.
故填:NH3;使溶液呈碱性,促进CO2的吸收,更多地析出沉淀.
(3)反应Ⅰ中,氯化钠和水、氨气、二氧化碳反应生成碳酸氢钠和氯化铵,反应的化学方程式为:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl.
故填:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl.
(4)流程中得到的母液中一定含有的溶质是NaHCO3、NH4Cl,流程中可以循环使用的物质是CO2.
故填:NaHCO3、NH4Cl;CO2.
(5)从图中可以看出温度高于60℃,NaHCO3的溶解度曲线“消失”了,其原因可能温度高于60℃时碳酸氢钠开始分解.
故填:温度高于60℃时碳酸氢钠开始分解.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
16.下列说法正确的是( )
| A. | pH等于8的溶液一定是碱的溶液 | |
| B. | 不饱和溶液变为饱和溶液溶质质量分数一定变大 | |
| C. | 所有的酸与活泼金属反应一定能生成氢气 | |
| D. | 金属与酸溶液发生置换反应时,生成的溶液质量一定大于原来酸溶液的质量 |
10.把少量的下列物质分别放入水中,充分搅拌,不能得到溶液的是( )
| A. | 植物油 | B. | 食盐 | C. | 蔗糖 | D. | 高锰酸钾 |

 用如图所示装置分别进行以下实验.
用如图所示装置分别进行以下实验.