题目内容
17. 如图是甲、乙、丙三种物质(其晶体均不含结晶水)的溶解度曲线.据图回答:
如图是甲、乙、丙三种物质(其晶体均不含结晶水)的溶解度曲线.据图回答:(1)t1℃时丙的溶解度是50g;
(2)将t3℃时甲、乙、丙三种物质的饱和溶液各100g,均降温到t2℃,则三种溶液中溶剂的质量大小关系正确的是D(填选项)
A.乙>甲=丙 B.甲=乙>丙
C.甲>乙>丙 D.丙>乙>甲
(3)t3℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是乙(填“甲”或“乙”)物质饱和溶液.
(4)下列说法正确的是BCD(填字母序号).
A.从t3℃甲、乙、丙的饱和溶液降温到t2℃时,析出晶体最多的是甲
B.将t2℃50g丙的饱和溶液加水稀释成溶质质量分数为10%的丙溶液,需要用到的仪器有:烧杯、玻璃棒、量筒(50ml)、胶头滴管
C. t3℃等质量甲、乙、丙的饱和溶液中,含溶剂最多的是丙
D.将接近饱和的甲溶液变成甲的饱和溶液,溶质质量分数可能不变.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度曲线可知,t1℃时丙的溶解度是50g;
(2)将t3℃时,甲物质的溶解度最大,乙物质的溶解度次之,丙物质的溶解度最小,所以甲、乙、丙三种物质的饱和溶液各100g,均降温到t2℃,三种溶液中溶剂的质量大小关系是:丙>乙>甲,故选:D;
(3)t3℃时,甲物质的溶解度大于乙物质的溶解度,所以从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是乙物质饱和溶液;
(4)A.从t3℃甲、乙、丙的饱和溶液降温到t2℃时,饱和溶液的质量不能确定,所以析出晶体的质量也不能确定,故A错误;
B.t2℃时,丙物质饱和溶液的质量分数为:$\frac{25g}{125g}$×100%=20%,将t2℃50g丙的饱和溶液加水稀释成溶质质量分数为10%的丙溶液,需要水的质量为:$\frac{20%×50g}{10%}$-50g=50g,所以需要用到的仪器有:烧杯、玻璃棒、量筒(50ml)、胶头滴管,故B正确;
C. t3℃时,甲物质的溶解度最大,乙物质的溶解度次之,丙物质的溶解度最小,所以等质量甲、乙、丙的饱和溶液中,含溶剂最多的是丙,故C正确;
D.将接近饱和的甲溶液变成甲的饱和溶液,降低温度使溶液达到饱和状态,溶质质量分数不变,故D正确.
故选:BCD.
故答案为:(1)50g;
(2)D;
(3)乙;
(4)BCD.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | 酸中都含有氢离子元素,所以含有含有氢离子的化合物一定是酸 | |
| B. | 碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性 | |
| C. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| D. | 碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 |
| A. |  氧气验满 | B. |  倾倒液体 | C. |  蒸发食盐水 | D. |  稀释浓硫酸 |
 有些年轻人喜欢染发,染发时一般要用到一种着色剂对苯二胺,它是一种有毒的化学药品,有致癌性,若使用不当会对染发者的身体带来伤害,其分子结构如图所示.下对有关对苯二胺的说法正确的是( )
有些年轻人喜欢染发,染发时一般要用到一种着色剂对苯二胺,它是一种有毒的化学药品,有致癌性,若使用不当会对染发者的身体带来伤害,其分子结构如图所示.下对有关对苯二胺的说法正确的是( )| A. | 对苯二胺由碳元素、氢元素和氮元素三种元素构成 | |
| B. | 对苯二胺是由多原子分子构成的有机物 | |
| C. | 对苯二胺分子含有58个电子 | |
| D. | 对苯二胺中氢元素和氮元素的质量比为7:2 |
| A. | 隔夜的白开水应及时倒掉 | |
| B. | 河水经过沉淀、过滤、吸附后即可除去所有杂质 | |
| C. | 生活中经常饮用蒸馏水对人体健康有益 | |
| D. | 洗菜时先把泥土抖干净后再清洗 |
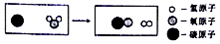
| A. | 生成的两种物质都属于单质 | B. | 生成物的分子个数比为1:1 | ||
| C. | 反应前后元素的化合价不变 | D. | 该反应不属于基本反应类型 |
 现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的短线“--”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)
现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的短线“--”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)
 下列选项符合图示从属关系的是( )
下列选项符合图示从属关系的是( )