题目内容
19.第Ⅰ部分:用化学方法可制取纯净的物质,化学兴趣小组应用中和反应原理制取氯化钠固体.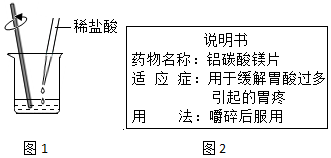
(1)往装有氢氧化钠溶液的烧杯中滴入紫色石蕊试液,溶液呈蓝色;
(2)如图1,往该烧杯中继续逐滴滴加稀盐酸至溶液恰好变为紫色,再往反应后的溶液中加入活性炭,充分混合,过滤后得到无色滤液.
①加入活性炭的目的是吸附有色物质;
②在过滤操作中,玻璃棒的作用是引流.
(3)用pH试纸测(2)中滤液的酸碱度,其操作方法:取pH试纸于玻璃片上,利用玻璃棒蘸取溶液,粘在pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH.
(4)若测得滤液pH为8,继续往滤液滴加稍过量的盐酸,目的是除去过量的氢氧化钠;蒸发该滤液以除去过量的盐酸,该操作利用的盐酸的性质是易挥发,继续蒸发滤液得到固体的过程中,用玻璃棒不断搅拌的目的是防止液体受热不均导致液滴飞溅.
第Ⅱ部分:胃酸过多须服用抗酸药物(能与盐酸反应).如图2为铝碳酸镁说明书的部分内容.兴趣小组对该药物开展如下探究.
(1)该药物抗酸作用的探究
资料表明,铝碳酸镁[其主要成分的化学式为AlMg(OH)3CO3]与盐酸反应的化学方程式为:AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑
①将反应产生的气体通入澄清石灰水,将观察到的现象是澄清石灰水变浑浊,该反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O.
②该物质中含有Al3+、Mg2+、OH-和CO32-.结合该物质与盐酸反应的化学方程式分析,该药物起抗酸作用(降低胃液酸性)的微粒是OH-、CO32-(填微粒符号).
(2)服用方法的探究
该抗酸药为什么要求“嚼碎后服用”?小红猜想可能是“对于相同质量的药片,嚼碎后服用,将消耗更多的胃酸”,小明则认为“嚼碎后药物将与胃液中的盐酸反应快”.
①显然,小红猜想是错误的.原因是相同质量的药片消耗的胃酸质量相等.
②小明设计了如下实验来证明自己的猜想:
【实验1】将一片完整的药片放入试管中,向其中加入5mL 5%的稀盐酸;
【实验2】将一片完整的药片研碎后放入试管中,向其中加入5mL 5%的稀盐酸.
对比实验1和实验2,小明观察到的现象为实验2中产生气泡的速率比实验1中的快,证明了他的猜想正确.
(3)主要成分含量的探究:兴趣小组取6片药片粉碎后放入试管中,向其加入足量的稀盐酸,充分反应后放出气体0.88g.试通过计算,每片药物中含有AlMg(OH)3CO3的质量是多少?(结果保留到0.1)
(已知:药物所含其他成分不与稀盐酸反应;AlMg(OH)3CO3的相对分子质量为162)
分析 第Ⅰ部分:
(1)氢氧化钠溶液显碱性,能使石蕊试液变蓝色;
(2)活性炭能够吸附色素、异味等;
在过滤操作中,玻璃棒的作用是引流;
(3)测定溶液pH的方法是:用洁净干燥的玻璃棒蘸取待测液,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH;
(4)稀盐酸和氢氧化钠反应生成氯化钠和水;
盐酸易挥发;
蒸发滤液得到固体的过程中,用玻璃棒不断搅拌的目的是使液体均匀受热;
第Ⅱ部分:
(1)二氧化碳能使澄清石灰水变浑浊;
(2)反应物接触面积越大,反应速率越快;
根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:第Ⅰ部分:
(1)往装有氢氧化钠溶液的烧杯中滴入紫色石蕊试液,溶液呈蓝色.
故填:蓝.
(2)①加入活性炭的目的是吸附有色物质;
②在过滤操作中,玻璃棒的作用是引流.
故填:吸附有色物质;引流.
(3)用pH试纸测(2)中滤液的酸碱度,其操作方法:取pH试纸于玻璃片上,利用玻璃棒蘸取溶液,粘在pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH.
故填:利用玻璃棒蘸取溶液,粘在pH试纸上.
(4)若测得滤液pH为8,继续往滤液滴加稍过量的盐酸,目的是除去过量的氢氧化钠;
蒸发该滤液以除去过量的盐酸,该操作利用的盐酸的性质是易挥发;
继续蒸发滤液得到固体的过程中,用玻璃棒不断搅拌的目的是防止液体受热不均导致液滴飞溅.
故填:除去过量的氢氧化钠;易挥发;防止液体受热不均导致液滴飞溅.
第Ⅱ部分:(1)①将反应产生的气体通入澄清石灰水,将观察到的现象是澄清石灰水变浑浊,这是因为氢氧化钙和二氧化碳反应生成了碳酸钙沉淀和水,该反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故填:澄清石灰水变浑浊; Ca(OH)2+CO2═CaCO3↓+H2O.
②该物质中含有Al3+、Mg2+、OH-和CO32-.结合该物质与盐酸反应的化学方程式分析,该药物起抗酸作用的微粒是OH-、CO32-,这是因为氢氧根离子能和稀盐酸中的氢离子结合成水,碳酸根离子能和稀盐酸中的氢离子结合生成水和二氧化碳.
故填:OH-;CO32-.
(2)①显然,小红猜想是错误的.原因是相同质量的药片消耗的胃酸质量相等.
故填:相同质量的药片消耗的胃酸质量相等.
②对比实验1和实验2,小明观察到的现象为实验2中产生气泡的速率比实验1中的快,证明了他的猜想正确.
故填:实验2中产生气泡的速率比实验1中的快.
(3)设每片药物中含有AlMg(OH)3CO3的质量为x,
AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑,
162 44
6x 0.88g
$\frac{162}{6x}$=$\frac{44}{0.88g}$,
x=0.5g,
答:每片药物中含有AlMg(OH)3CO3的质量是0.5g.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

| A. | 二氧化碳通入紫色石蕊溶液中,溶液由紫色变为红色 | |
| B. | 铁丝在空气中剧烈燃烧,火星四射,生成四氧化三铁 | |
| C. | 涤纶和羊毛点燃时,都可闻到一股烧焦的羽毛气味 | |
| D. | 在电解水实验中,与正极、负极相连的玻璃管内收集到的气体体积比约为2:1 |
| 次数 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
| 生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(2)求恰好完全反应时,溶液中溶质的质量分数.(结果精确到0.1%)

(3)请在图中画出在20g 样品中加氢氧化钠溶液的质量与产生沉淀质量变化关系的示意图.
(4)若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由氢氧化钡也会与杂质硫酸钠反应,导致测定结果偏大.
| A. | 回收利用废旧金属,不仅可以节约金属资源,还可以减少对环境的污染 | |
| B. | 金属资源中,只有金、银能以单质形式存在 | |
| C. | 煤是复杂的混合物,主要含有碳、氢元素 | |
| D. | 人们正在利用和开发其他能源有太阳能、核能、风能、水能、地热能和潮汐能、氢能 |
| A. | 鉴别二氧化锰和碳粉--观察颜色 | |
| B. | 鉴别棉线和羊毛线--灼烧,闻气味 | |
| C. | 分离食盐和泥沙--蒸发结晶 | |
| D. | 除去氯化钠溶液中少量氯化钙--加入氢氧化钠溶液 |
| A. | 塑料、纤维、橡胶都属于有机合成材料 | |
| B. | 当人体缺乏维生素C时,会引起坏血病 | |
| C. | 生活中通过煮沸可以降低水的硬度 | |
| D. | 使用一些新型的、可降解的塑料是解决“白色污染”的有效措施之一 |
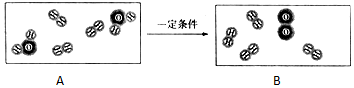
 和
和  分别表示氢原子和氧原子,下图是水在通电条件下发生反应的微观模拟图.
分别表示氢原子和氧原子,下图是水在通电条件下发生反应的微观模拟图.