题目内容
11.化学与我们的生活息息相关.(1)包饺子的食材有面粉、韭菜、瘦肉、植物油、食盐等.其中富含糖类的是面粉,不属于有机物的是食盐.
(2)老年人缺钙会发生骨质疏松,容易骨折.
(3)塑料盆、铁锅,陶瓷茶杯等是生活常见用品,其中属于有机合成材料的是塑料盆.
(4)活性炭能除去家庭装修中产生的有害气体,这是利用了活性炭的吸附性.
(5)加了洗涤剂的水能除去衣服上的油污,是利用了洗涤剂的乳化作用.
(6)下列关于水的说法错误的是D
A.煮沸可以将硬水转化为软水
B.工业废气直接排放会造成水污染
C.寻找合适的催化剂,利用光照使水分解是理想的制氢方法
D.大量使用农药、化肥能提高农作物产量,不会造成水污染
(7)过氧化钙( CaO2) 能用于鱼类运输时的制氧剂,与水反应生成碱和一种气体,写出反应的化学方程式2CaO2+2H2O═2Ca(OH)2+O2↑.
(8)某注射用药液的配制方法如下:
①把 1.0g 药品溶于水配制成 4.0mL 溶液 a;
②取 0.1mL 溶液 a,加水稀释至 1.0mL,得溶液 b;
③取 0.1mL 溶液 b,加水稀释至 1.0mL,得溶液 c;
④取 0.4mL 溶液 c,加水稀释至 1.0mL,得溶液 d.
由于在整个配制过程中药液很稀,其密度都可近似看做1g/cm3,1g 该药品可配制溶液d 的体积是1000mL.
分析 (1)根据食物中富含的营养素进行分析解答;
(2)根据钙的生理功能和缺乏症进行分析;
(3)根据材料的分类进行分析;
(4)根据活性炭具有吸附作用进行分析;
(5)根据洗涤剂的乳化作用进行分析;
(6)A、根据硬水软化的方法进行分析;
B、根据工业废气中含有有毒成分进行分析;
C、现在氢能源作为人类理想中的能源大量使用还需解决合适的光照条件下分解水的催化剂、运输和储存问题;
D、根据大量使用农药、化肥的危害进行分析;
(7)根据过氧化钙和水反应生成氢氧化钙和氧气进行分析;
(8)溶质的质量分数=$\frac{溶质质量}{溶液质量}$×100%,并利用稀释前后溶质的质量不会改变的知识解决,分步求出各部得到的溶液的溶质质量分数即可;.
解答 解:(1)面粉中富含淀粉,淀粉属于糖类;瘦肉中富含蛋白质;植物油中富含油脂;食盐属于无机盐;
(2)人体中缺钙,幼儿及青少年会得佝偻病;老年人会患骨质疏松症;
(3)塑料属于有机合成材料;
(4)活性炭具有吸附作用,能够吸附色素和异味;
(5)使用洗涤剂轻松除去了衣服上的油污,这是利用了洗涤剂的乳化功能;
(6)A、生活中的常用加热煮沸的方法将硬水转化为软水,故说法正确;
B、工业废气中含有有毒成分,直接排放会造成水污染和空气污染,故说法正确;
C、氢能源作为人类理想中的能源,大量使用还需解决合适的光照条件下分解水的催化剂、运输和储存问题,最经济最理想的获得氢能源的循环体系中最重要的是光分解催化剂,故说法正确;
D、大量使用农药、化肥会造成水污染,故说法错误;
(7)过氧化钙和水反应生成氢氧化钙和氧气,该反应的化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑;
(8)因为溶液的密度是1g/cm3,所以可直接看成毫升数即是物质的克数,然后利用溶质的质量分数=$\frac{溶质质量}{溶液质量}$×100%计算即可.
溶质的质量=1.0g;
溶液的质量=4.0mL×1g/cm3=4.0cm3×1g/cm3=4.0g;
所以,溶液a中溶质的质量分数=$\frac{1.0g}{4.0g}$×100%=25%;
溶液b的质量分数=$\frac{0.1g×25%}{1g}$×100%=2.5%;
溶液c的质量分数=$\frac{0.1g×2.5%}{1g}$×100%=0.25%;
溶液d的质量分数=$\frac{0.4g×0.25%}{1g}$×100%=0.1%;
设1.0g药品可配制质量为x的试验针药液,则
$\frac{1.0g}{x}$×100%=0.1%,
解得x=1000g;
由于密度看成1g/mL,所以也就是1000mL;
故答案为:(1)面粉;食盐;(2)钙/Ca;(3)塑料盆;(4)吸附;(5)乳化;(6)D;(7)2CaO2+2H2O=2Ca(OH)2+O2↑;(8)1000.
点评 化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一.

| A. | 长期饮用纯净水,有利于身体健康 | |
| B. | 为保证身体健康,食品中禁止使用任何食品添加剂 | |
| C. | 注意个人卫生,全部使用一次性的木筷和餐盒 | |
| D. | 步行或使用新型的“零排放”无污染交通工具,如公共自行车,共享单车等 |
| A. | 提倡农家肥与化肥综合利用 | |
| B. | 草木灰是一种农家肥,其主要成分中含有钾元素 | |
| C. | 磷肥的主要作用是促进植铆茎、叶生长茂盛,叶色浓绿 | |
| D. | 常用作氮肥的化合物有尿素、碳酸氢铵等 |
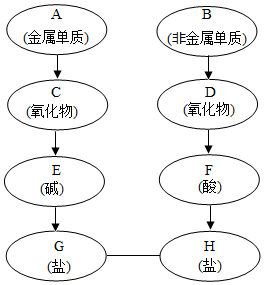 A~H分别是氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质(如图所示.箭头表示物质间能转化,实线表示物质间能反应).请回答:
A~H分别是氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质(如图所示.箭头表示物质间能转化,实线表示物质间能反应).请回答: